
| A. | 此盐酸溶液与蒸馏水等体积混合后,所得溶质的质量分数小于$\frac{ω}{2}$ | |
| B. | 此盐酸溶液与蒸馏水等质量混合后,所得溶液的物质的量浓度小于$\frac{c}{2}$ mol/L | |
| C. | c=$\frac{1000Vd}{36.5V+22400}$ | |
| D. | ω=$\frac{36.5V}{36.5V+22400}$ |
分析 A.稀盐酸的密度大于蒸馏水的密度,等体积混合后所得溶液的质量稀盐酸质量的2倍,根据溶质质量分数=$\frac{m(溶质)}{m(溶质)+m(溶剂)}$×100%分析;
B.盐酸浓度越大其密度越大,盐酸密度大于水密度,等质量盐酸和水,水的体积大于盐酸体积;
C.根据n=$\frac{V}{{V}_{m}}$计算HCl物质的量,再根据m=nM计算其质量,根据m=ρV计算水的质量,进而计算溶液质量,再根据V=$\frac{m}{ρ}$计算溶液体积,根据c=$\frac{n}{V}$计算;
D.根据溶质质量分数=$\frac{m(溶质)}{m(溶质)+m(溶剂)}$×100%计算分析.
解答 解:A.稀盐酸的密度大于蒸馏水的密度,等体积混合后所得溶液的质量稀盐酸质量的2倍,溶质质量分数=$\frac{m(溶质)}{m(溶质)+m(溶剂)}$×100%,所得混合溶液中溶质的质量分数大于$\frac{ω}{2}$,故A错误;
B.盐酸浓度越大其密度越大,盐酸密度大于水密度,等质量盐酸和水,水的体积大于盐酸体积,所以二者混合后溶液体积大于混合前盐酸体积的二倍,则其物质的量浓度小于原来的$\frac{1}{2}$,即小于$\frac{c}{2}$ mol/L,故B正确;
C.HCl物质的量为$\frac{V}{22.4}$mol,其质量为$\frac{V}{22.4}$mol×36.5g/mol=$\frac{36.5V}{22.4}$g,1L水的质量为1000g,计算溶液质量为:(1000+$\frac{36.5V}{22.4}$)g,则溶液体积为$\frac{1000+\frac{36.5V}{22.4}}{1000d}$L,故溶液浓度c=$\frac{\frac{V}{22.4}}{\frac{1000+\frac{36.5V}{22.4}}{1000d}}$=$\frac{1000Vd}{36.5V+22400}$mol/L,故C正确;
D.HCl物质的量为$\frac{V}{22.4}$mol,其质量为$\frac{V}{22.4}$mol×36.5g/mol=$\frac{36.5V}{22.4}$g,1L水的质量为1000g,计算溶液质量为:(1000+$\frac{36.5V}{22.4}$)g,溶质质量分数ω=$\frac{m(溶质)}{m(溶质)+m(溶剂)}$×100%=$\frac{\frac{36.5V}{22.4}}{1000+\frac{36.5V}{22.4}}$=$\frac{36.5V}{36.5V+22400}$,故D正确;
故选A.
点评 本题考查物质的量浓度的有关计算,明确物质的性质、溶液稀释特点等知识点为解答关键,注意对公式的理解与灵活应用,题目难度中等.


 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 加入NaClO将污水中的NH3氧化成N2:3ClO-+2NH3=N2↑+3Cl-+3H2O | |
| B. | 泡沫灭火器的灭火原理:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑ | |
| C. | “84消毒液”和“洁厕灵”(主要成分为盐酸)混合使用会产生有毒气体:ClO3-+5Cl-+6H+=3Cl2↑+3H2O | |
| D. | 用足量的氨水吸收硫酸工业尾气中的SO2:SO2+NH3•H2O=NH4++HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 以下是我校化学兴趣小组的同学测定厨房食醋中醋酸浓度的实验,请你参与并完成相关实验:
以下是我校化学兴趣小组的同学测定厨房食醋中醋酸浓度的实验,请你参与并完成相关实验:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
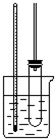 实验室制备硝基苯的主要步骤如下:
实验室制备硝基苯的主要步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| B. | 实验室制取蒸馏水的装置中,温度计水银球应位于蒸馏烧瓶的支管口处 | |
| C. | 用萃取的方法分离碘水 | |
| D. | 用蒸发方法使NaCl从溶液中析出时,应边加热边搅拌直至溶液蒸干 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将NaHCO3、Na2SO3、FeCl3溶液蒸干灼烧均得不到原溶质 | |
| B. | 保存氯化亚铁溶液时,在溶液中放少量铁粉,以防止Fe2+水解 | |
| C. | 室温下,向0.1mol/L的CH3COOH溶液中加入少量水溶液显碱性的物质,CH3COOH的电离程度一定增大 | |
| D. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示装置中,M棒变细,N棒变粗.由此判断下表中所列M、N、R物质,其中合理的是( )
如图所示装置中,M棒变细,N棒变粗.由此判断下表中所列M、N、R物质,其中合理的是( )| M | N | R | |
| A | 锌 | 铜 | 稀硫酸 |
| B | 铜 | 铁 | 硫酸铜 |
| C | 铁 | 铜 | 硝酸银 |
| D | 铜 | 铁 | 氯化铁 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com