
【题目】体育竞技中服用兴奋剂既有失公平,也败坏了体育道德,以下是其中检测出的两种兴奋剂的结构:(注:苯环上的卤原子不易水解,但在一定条件下遇碱液也能缓慢水解)

关于它们的说法中正确的是
A. Y遇到氯化铁溶液时显紫色,并能发生加成、消去、水解等反应
B. 1个Y分子中最多有8个碳原子共面
C. 1molX与足量氢气反应,最多可消耗6molH2
D. 在一定条件下, 1mol X与足量NaOH溶液反应,最多消耗5mol NaOH
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】三硫化四磷是黄绿色针状结晶,其结构如图所示,不溶于冷水,溶于叠氮酸、二硫化碳、苯等有机溶剂,在沸腾的NaOH稀溶液中会迅速水解。回答下列问题:

(1)Se是S的下一周期同主族元素,其核外电子排布式为____________;
(2)第一电离能:S_______ (填“>”“<”或“=”,下同)P;电负性:S________P。
(3)三硫化四磷分子中P原子采取________杂化,与PO3-互为等电子体的化合物分子的化学式为______。
(4)二硫化碳属于__________(填“极性”或“非极性”)分子。
(5)用NA表示阿伏加德罗常数的数值,0.1mol三硫化四磷分子中含有的孤电子对数为_____。
(6)纯叠氮酸(HN3)在常温下是一种液体,沸点较高,为308.8K,主要原因是_______。
(7)氢氧化钠具有NaCl型结构,其晶饱中Na+与OH-之间的距离为acm,晶胞中Na+的配位数为__________,用NA表示阿伏加德罗常数的数值,NaOH的密度为___________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置可应用于实验室制氯气并回收二氯化锰的实验,能达到实验目的的是
A.用装置甲制取氯气
B.用装置乙除去氯气中的少量氯化氢
C.用装置丙分离出MnCl2溶液中的固体MnO2
D.用装置丁称得回收的二氯化锰质量为5.36 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质分类或归类正确的一组是
①液氯、干冰、磁性氧化铁均为化合物
②氢氟酸、盐酸、水玻璃均为混合物
③明矾、小苏打、烧碱均为电解质
④牛奶、豆浆、漂粉精均为胶体
⑤Na2O2、Na2CO3、Na2SiO3均为钠盐
A. ①② B. ②③ C. ③④ D. ②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.80 mol·L-1NaOH溶液480 mL和0.40 mol·L-1硫酸500 mL。根据这两种
溶液的配制情况回答下列问题:
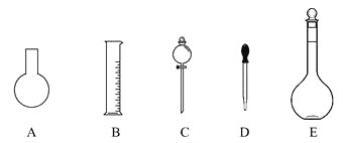
(1)如图所示的仪器中配制溶液肯定不需要的是_____(填字母),配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。
(2)根据计算用托盘天平称取NaOH的质量为__g,应放在_________(填仪器名称)称量。
(3)根据计算得知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为
______mL(计算结果保留一位小数)。如果实验室有10 mL、15 mL、20 mL、50 mL的量筒,应选用____mL的量筒最好。
(4)下列操作会引起所配溶液浓度偏大的是____(填字母)。
A.用量筒量取浓硫酸时,仰视量筒的刻度
B.向容量瓶中转移时,有少量液体溅出
C.定容时仰视刻度线
D.定容后倒置摇匀后再正立时,发现液面低于刻度线
(5)温度计、量筒、滴定管的一部分如图所示,下述读数 (虚线所指刻度)及说法正确的是____(填字母)。
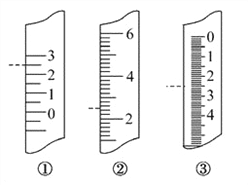
A.①是量筒,读数为2.5 mL B.②是量筒,读数为2.5 mL
C.③是滴定管,读数为2.5 mL D.①是温度计,读数为2.5℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按下面的实验过程完成下题:

(1)写出上述过程颜色变化(a)________;(b)______;(d)________。
(2)写出上述反应的化学方程式:(1)____________;(3)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组以粗镍(含少量Fe和Cr杂质)为原料制备Ni(NH3)6Cl2,并测定相关组分的含量。制备流程示意图如下:
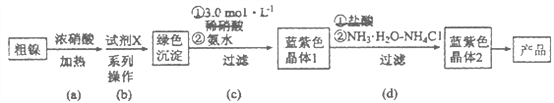
已知:①部分离子生成氢氧化物沉淀的pH(开始沉淀的pH按离子浓度为0.1 mol·L-1计算)如下表所示:
离子 | Fe3+ | Cr3+ | Ni2+ |
开始沉淀pH | 1.5 | 4.3 | 6.9 |
完全沉淀pH | 2.8 | 5.6 | 8.9 |
②Ni(OH)2为绿色难溶物。Ni(NH3)6(NO3)2、Ni(NH3)6Cl2均为可溶于水的蓝紫色晶体,水溶液均显碱性。
回答下列问题:
(1)实验需要配制3.0mol·L-1稀硝酸250mL,需要的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管和_________________。
(2)步骤(a)中Ni和浓硝酸反应的化学方程式为________________。
(3)步骤(b)首先加入试 剂X调节溶液的pH约为6,过滤后再继续加入X调节pH以得到绿色沉淀。
①调节pH约为6的原因是_______________________________________________。
②试剂X可以是__________________(填标号)。
A. H2SO4 B. Ni(OH)2 C. NaOH D. Fe2O3 E. NiO
(4)NH3含量的测定
i. 用电子天平称量mg产品于锥形瓶中,用25mL水溶解后加入3.00mL 6 mol/L盐酸,以甲基橙作指示剂,滴定至终点消耗0.500 0 mol·L-1NaOH标准溶液V1mL;
ii. 空白试验:不加入样品重复实验i,消耗NaOH标准溶液V2mL。
NH3的质量分数为____________。(用V1 ,V2表示)
②在上述方案的基础上,下列措施能进一步提高测定准确度的有____________(填标号)。
A. 适当提高称量产品的质量 B. 用H2SO4溶液替代盐酸
C. 用酚酞替代甲基橙 D. 进行平行实验
(5)为测定Cl-的含量,请补充完整下述实验方案。
称量mg产品于锥形瓶中,用25mL水溶解,________________,滴入2~3滴K2CrO4溶液作指示剂,用已知浓度的AgNO3标准溶液滴定至终点,记录读数,重复操作2~3次。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下物质分类组合正确的是 ( )
A | B | C | D | |
强电解质 | HCl | FeCl3 | H3PO4 | HClO |
弱电解质 | HF | CH3COOH | NH3·H2O | Ba(OH)2 |
非电解质 | C2H5OH | Zn | H2O | SO3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. O3是由3个氧原子构成的化合物
B. 稀H2SO4能导电,所以稀H2SO4是电解质
C. 根据交叉分类法MgSO4既是镁盐又是硫酸盐
D. 根据是否有丁达尔效应将分散系分为溶液、胶体和浊液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com