
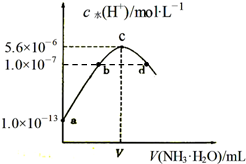
 常温下,向20mL某浓度的硫酸溶液中滴入0.1mol•L-1氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图.下列分析正确的是( )
常温下,向20mL某浓度的硫酸溶液中滴入0.1mol•L-1氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图.下列分析正确的是( )| A. | 由图可知稀硫酸的浓度为0.1 mol•L-1 | |
| B. | b点溶液pH=7 | |
| C. | c点所示溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | d点所示溶液中:c(NH4+)=2c(SO42-) |
分析 A、氨水体积为0时,水电离出氢离子的浓度为1×10-13mol/L,所以水电离出的氢氧根离子的浓度为1×10-13mol/L,所以溶液中中氢离子的浓度为0.1mol/L,所以稀硫酸的浓度为0.05mol/L;
B、c点水的电离程度最大,铵根离子浓度最大,两者恰好完全反应生成硫酸铵,而b点硫酸过量;
C、c点所示溶液是硫酸铵溶液,二元的铵根离子浓度最大,溶液呈酸性;
D、根据电荷守恒:c(H+)+c(NH4+)═2c(SO42-)+c(OH-),而溶液呈中性c(OH-)═c(H+),由此分析.
解答 解:A、氨水体积为0时,水电离出氢离子的浓度为1×10-13mol/L,所以水电离出的氢氧根离子的浓度为1×10-13mol/L,所以溶液中中氢离子的浓度为0.1mol/L,所以稀硫酸的浓度为0.05mol/L,而不是0.1 mol•L-1,故A错误;
B、c点水的电离程度最大,铵根离子浓度最大,两者恰好完全反应生成硫酸铵,而b点硫酸过量,所以pH<7,故B错误;
C、c点所示溶液是硫酸铵溶液,二元的铵根离子浓度最大,溶液呈酸性,所以离子浓度大小为:c(NH4+)>c(SO42-)>c(H+)>c(OH-),故C错误;
D、根据电荷守恒:c(H+)+c(NH4+)═2c(SO42-)+c(OH-),而溶液呈中性c(OH-)═c(H+),所以c(NH4+)═2c(SO42-),故D正确;
故选D.
点评 本题考查学生酸碱混合的酸碱性的判断以及盐的水解原理的应用知识,属于综合知识的考查,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:推断题
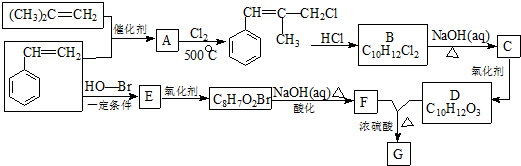
 .
. .
.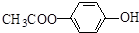 和
和 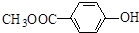 .
.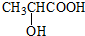 ) 的合成线路
) 的合成线路 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X的最高正价和最低负价的绝对值相等,Y有三个能级,且每个能级上的电子数相等,Z原子未成对电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:
X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X的最高正价和最低负价的绝对值相等,Y有三个能级,且每个能级上的电子数相等,Z原子未成对电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 如果存放有钠、电石等危险化学品的仓库着火,消防员不能用水灭火,应用泡沫灭火器灭火 | |
| B. | 用石英制成光导纤维,由水玻璃制硅胶都是化学变化 | |
| C. | 火法炼铜、湿法炼铜都是置换反应 | |
| D. | 糖类、油脂、蛋白质都是高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
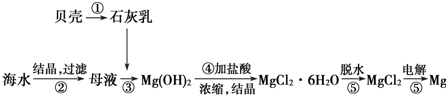
| A. | 用此法提取镁的优点之一是原料来源丰富 | |
| B. | 电解MgCl2时阳极产生镁 | |
| C. | 步骤⑤可将晶体置于HCl气体氛围中脱水制无水氯化镁 | |
| D. | 上述工艺流程中涉及到化合、分解和复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
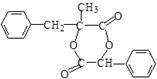
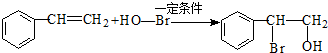
 .
. +nOHCH2CH2OH$\stackrel{一定条件}{→}$
+nOHCH2CH2OH$\stackrel{一定条件}{→}$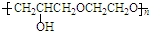 +nHCl
+nHCl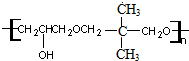 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、W、U的最高价氧化物对应的水化物酸性由强到弱的顺序为:U>W>X | |
| B. | Y、Z元素的单质作电极,在氢氧化钠溶液中构成原电池,Z电极上产生大量气泡 | |
| C. | 室温下,0.05.mol•L-1U的气态氢化物的水溶液的pH>1 | |
| D. | Y、Z、U元素的简单离子半径由大到小的顺序:Y>Z>U |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的氢化物的沸点比R的氢化物的沸点高 | |
| B. | Z、W、R按最高价氧化物对应水化物的酸性强弱排列顺序是R>W>Z | |
| C. | X2Y2化合物中的化学键与X2R中的化学键类型完全相同 | |
| D. | RY2通入Ba(NO3)2溶液中有白色沉淀生成,该沉淀不溶于硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 溶质 | NaF | NaClO | Na2CO3 |
| pH | 7.5 | 9.7 | 11.6 |
| A. | 根据上表,向足量NaClO溶液中通入CO2:CO2+H2O+2ClOˉ═2HClO+CO32- | |
| B. | 向上述 NaClO溶液中通HF气体至恰好完全反应时:c(Na+)>c(F-)>c(HClO) | |
| C. | 在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF | |
| D. | 若将CO2通入0.1mol•L-1Na2CO3溶液中至溶液中性,则溶液中2c(CO32-)+c (HCO3-)=0.1 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com