
| A. | a<7 | |
| B. | 该溶液中水电离的c(OH-)=10-amol/L | |
| C. | CH3COO-水解的百分率为$\frac{10-a}{0.1}$×100% | |
| D. | c(CH3COOH)=(l0a-14-10-a)mol/L |
分析 A.强碱弱酸盐在溶液中水解显碱性;
B.根据Kw=c(H+)×c(OH-)计算;
C.水解离子方程式可知,CH3COO-+H2O?CH3COOH+OH-,水解的醋酸根离子浓度近似为10-14+a;
D.溶液中存在质子守恒计算;
解答 解:A.25℃时,0.1mol/L的CH3COONa溶液的pH=a,醋酸钠为强碱弱酸盐,醋酸根离子水解溶液显碱性,PH>7,故A错误;
B.溶液PH=a,水电离出氢氧根离子浓度=$\frac{1{0}^{-14}}{1{0}^{-a}}$=10-14+a,故B错误;
C.水解离子方程式可知,CH3COO-+H2O?CH3COOH+OH-,水解的醋酸根离子浓度近似为10-14+a,水解百分率=$\frac{1{0}^{-14+a}}{0.1}$×100%,故C错误;
D.25℃时,0.1mol/L的CH3COONa溶液的pH=a,c(H+)=10-amol/L,c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-a}}$=10-14+amol/L,溶液中存在质子守恒,c(OH-)=c(H+)+c(CH3COOH),c(CH3COOH)=c(OH-)-c(H+)=10-14+amol/L-10-amol/L,故D正确;
故选D.
点评 本题考查了盐类水解、弱电解质电离平衡影响因素,电解质溶液中质子守恒等,掌握基础是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水,产生黄绿色气体:2NaCl+2H2O═2NaOH+H2↑+Cl2↑ | |
| B. | 用Na2CO3溶液将水垢中的CaSO4转化为CaCO3:CO32-+Ca2+═CaCO3↓ | |
| C. | 向H2O2溶液中滴加CuSO4溶液,产生气泡:H2O2═H2O+O2↑ | |
| D. | 向苯酚浊液中滴加Na2CO3溶液,溶液变澄清: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水泥、水玻璃、水晶均属于硅酸盐产品 | |
| B. | 医用酒精和葡萄糖注射液可用丁达尔效应区分 | |
| C. | 氯水和食盐水消毒杀菌的原理相同 | |
| D. | 铵态氮肥和草木灰混合使用会降低肥效 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 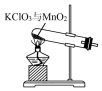 制取氧气 | B. | 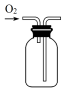 收集氧气 | C. | 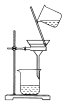 分离出MnO2 | D. |  蒸发结晶得KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
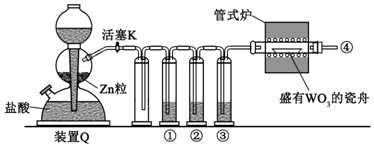
| A. | ①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液 | |
| B. | 管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体浓度 | |
| C. | 结束反应时,先关闭活塞K,再停止加热 | |
| D. | 装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,VL气态烯烃(CnH2n)含碳碳双键的数目为$\frac{V}{22.4}$ NA | |
| B. | 在8.4 g NaHCO3晶体中,所含离子数目为0.3NA | |
| C. | 5.6g铁粉与稀硝酸反应,转移的电子数是0.3 NA | |
| D. | 在沸水中滴加含0.1 molFe3+的FeCl3饱和溶液,得到的Fe(OH)3胶粒数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类化合物也可称为碳水化合物 | |
| B. | 维生素D可促进人体对钙的吸收 | |
| C. | 蛋白质是仅由碳、氢、氧元素组成的物质 | |
| D. | 硒是人体必需的微量元素,但不宜摄入过多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 化合物 | SiCl4 | TiCl4 | AlCl3 | FeCl3 | MgCl2 |
| 沸点/℃ | 58 | 136 | 181(升华) | 316 | 1412 |
| 熔点/℃ | -69 | 25 | 193 | 304 | 714 |
| 在TiCl4中的溶解性 | 互溶 | - | 微溶 | 难溶 | |
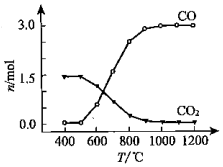
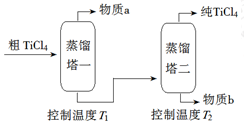
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色透明的溶液中:Fe3+、Mg2+、SCN -、Cl - | |
| B. | c(H+)/c(OH-)=1×10 -12的溶液中:K+、Na+、CO32-、NO3- | |
| C. | c(Fe2+ )=1 mol•L-1的溶液中:K+、NH4+、MnO4-、SO42- | |
| D. | 能使甲基橙变红的溶液中:Na+、NH4+、SO42-、HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com