
分析 W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大.W、Y的氧化物是导致酸雨的主要物质,W为N,Y为S,X的基态原子核外有7个原子轨道填充了电子,s有1个轨道,p有3个轨道,则电子排布为1s22s22p63s23p1,X为Al,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物,Z为Cu,以此来解答.
解答 解:(1)W为N,位于第二周期VA族,非金属性O大于N,则W的气态氢化物稳定性比H2O(g)弱,
故答案为:二;VA;弱;
(2)Y的基态原子核外电子排布式是1s22s22p63s23p4,金属性Al大于S,则Y的第一电离能比X的大,
故答案为:1s22s22p63s23p4;大;
(3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(4)①Fe(s)+$\frac{1}{2}$O2(g)=FeO(s)△H=-272.0kJ•mol-1
②2Al(s)+$\frac{3}{2}$O2(g)=Al2O3(s)△H=-1675.7kJ•mol-1
由盖斯定律可知②-①×3得到3FeO(s)+2Al(s)=Al2O3(s)+3Fe(s),△H=(-1675.7kJ•mol-1)-(-272.0kJ•mol-1)×3=-859.7KJ/mol,
即热化学方程式为3FeO(s)+2Al(s)=Al2O3(s)+3Fe(s)△H=-859.7KJ/mol,
故答案为:3FeO(s)+2Al(s)=Al2O3(s)+3Fe(s)△H=-859.7KJ/mol.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素化合物知识、电子排布来推断元素为解答的关键,侧重分析与应用能力的考查,注意元素化合物及反应原理的应用,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2O2做氧化剂 | B. | Na2O2做还原剂 | ||
| C. | Na2O2既做氧化剂又做还原剂 | D. | Na2O2既不做氧化剂又不做还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
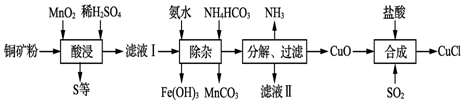
| 序号 | 温度/℃ | 压强/kPa | 时间/min | 残液颜色 |
| A | 110 | 101.3 | 60 | 浅蓝色 |
| B | 100 | 74.6 | 40 | 很浅 |
| C | 90 | 60.0 | 30 | 无色透明 |
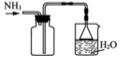
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X表示的平均反应速率为0.3mol/(L•min) | |
| B. | n的值等于2 | |
| C. | 平衡时,Y的浓度为1mol/L | |
| D. | 平衡时,Y的转化率为20% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
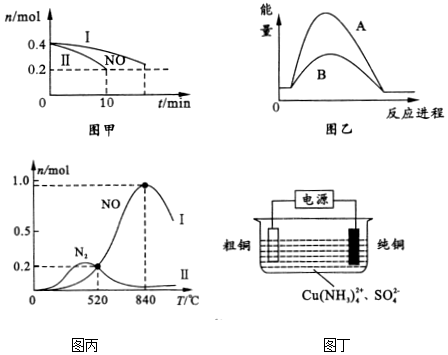
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | {[100(b-a)]/(b-a+m)}% | B. | [100b/(b+m)]% | C. | [100(b-a)/m]% | D. | [100(b-m)/(b+m)]% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②③ | C. | ①② | D. | ① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氯可使湿的红布条褪色,所以液氯具有漂白性 | |
| B. | 氯气没有漂白性,但会使湿润的红色布条褪色 | |
| C. | 在通常情况下,氯气可以和任何金属直接化合 | |
| D. | 氯气有毒,可以用澄清的石灰水尾气吸收;久置的氯水最终变为稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸滴在银片上:2Ag+2H+═2Ag++H2↑ | |
| B. | 稀硫酸与氢氧化钡溶液混合:SO42-+Ba2+═BaSO4↓ | |
| C. | 稀硝酸滴在大理石上:CO32-+2H+═Ca2++H2O+CO2↑ | |
| D. | 氧化铁与稀盐酸混合:Fe2O3+6H+═2Fe3++3H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com