
| A. | 氯化钠溶于水中 | B. | CaCO3(S)分解为CaO(S)和CO2(g) | ||
| C. | 干冰的升华 | D. | NH3(g)和HCl(g)反应生成NH4Cl |
科目:高中化学 来源: 题型:选择题
| A. | 5种 | B. | 6 种 | C. | 8种 | D. | 10种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 保持体积不变,充入H2O(g)使体系压强增大 | |
| B. | 将容器的体积缩小一半 | |
| C. | 保持体积不变,充入N2使体系压强增大 | |
| D. | 保持压强不变,充入N2使容器体积变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
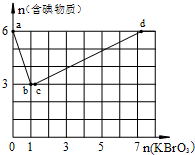 现向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示.
现向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
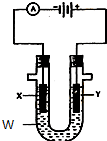 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液w;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液w;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NA个CO2分子占有的体积一定为22.4L | |
| B. | 标准状况下,22.4L四氯化碳含有的分子数为NA | |
| C. | 常温常压下,1.06g Na2CO3含有的Na+数为0.02 NA | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含Cl-个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaO | B. | Na2Ca | C. | Si02 | D. | CaC03 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸钾 | B. | 醋酸钠 | C. | 硫酸氢钠 | D. | 硫酸铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
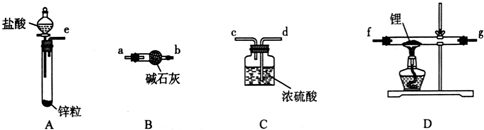
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com