
| A. | 拉瓦锡 | B. | 道尔顿 | C. | 阿伏加德罗 | D. | 门捷列夫 |
 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:选择题
| A. | 室温下,在水中的溶解度:乙醇>苯酚>乙酸乙酯 | |
| B. | 乙二醇和丙三醇互为同系物 | |
| C. | 分子式为C7H8O且属于酚类物质的同分异构体有4种 | |
| D. | 甲苯能使酸性高锰酸钾溶液褪色,说明甲基使苯环变活泼 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | Y | |
| Z | W |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某烯烃与氢气加成得2,2-二甲基丁烷,该烯烃是2,2-二甲基-1-丁烯 | |
| B. | 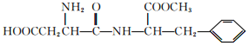 能发生水解反应,且与酸、碱均能反应 能发生水解反应,且与酸、碱均能反应 | |
| C. | 合成纤维、人造纤维及碳纤维都属于有机高分子材料 | |
| D. | 为检验某卤代烃中的卤素原子,应取少量卤代烃于试管中加入氢氧化钠溶液煮沸,冷却后加硝酸银溶液,然后根据卤化银沉淀的颜色确定卤素原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2、H2、NH3在容器中共存 | B. | N2、H2、NH3的浓度不改变 | ||
| C. | 反应已达到化学平衡状态 | D. | N2、H2完全转化为NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将浓硝酸分别放在冷暗处和强光照射卞,会发现光照可以加快浓硝酸的分解 | |
| B. | 将形状、大小均相同的镁条和铝条与相同浓度的盐酸反应时,两者速率一样 | |
| C. | 在相同条件下,等质量的大理石块和大理石粉末与相同浓度的盐酸反应,大理石粉末反应快 | |
| D. | 两只试管中分别加入相同质量的氯酸钾,其中一只试管中再加入少量二氧化锰,同时加热,加入二氧化锰的试管中产生氧气快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 pH为4的KHC2O4溶液中:c(HC2O4-)>c(H2C2O4)>c(C2O42-) | |
| B. | pH=2的HF溶液与pH=12的氢氧化钠溶液等体积混合,所得溶液中:c(Na+)+c(OH-)>c(H+)+c(F-) | |
| C. | 向0.1mol/L的Na2S溶液中通入H2S至溶液呈中性(忽略体积变化),则溶液中:c(HS-)+2c(S2-)=0.2mol/L | |
| D. | 相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com