
| 溶液 | a | b | c | d | e | f | a |
| 溶质 | CH3COONa | NaHCO3 | NaClO | NaCN | C6H5ONa | Na2CO3 | CH3COONa |
| pH | 8.8 | 9.0 | 10.3 | 11.1 | 11.3 | 11.6 | 8.8 |
| 10-14 |
| 10-8.8 |
| 10-14 |
| 10-5.2 |
| Kw |
| c(H+) |


科目:高中化学 来源: 题型:
c[Cu(NH3
| ||
| c(Cu2+)?c4(NH3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
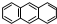 分子式C14H10)反应生成蒽醌(
分子式C14H10)反应生成蒽醌(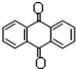 分子式C14H8O2),反应式为(未配平)C14H10(蒽)+KMnO4+H2SO4→C14H8O2(蒽醌)+K2SO4+MnSO4+H2O.
分子式C14H8O2),反应式为(未配平)C14H10(蒽)+KMnO4+H2SO4→C14H8O2(蒽醌)+K2SO4+MnSO4+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:
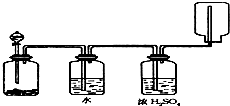 如图装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体,该装置可用于( )
如图装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体,该装置可用于( )| A、二氧化锰和双氧水反应生成氧气 |
| B、浓氨水和生石灰混合生成氨气 |
| C、Na2SO3和浓H2SO4混合生成SO2 |
| D、锌粒与稀盐酸混合生成H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,某难溶物的Ksp为2.5×105 | ||||
| B、反应2Mg(s)+CO2(g)=C(s)+2MgO(s)能自发进行,则该反应的△H<0 | ||||
C、NH3?H2O溶液加水稀释后,溶液中
| ||||
| D、常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,铜与氧气很难反应,因为铜和氧气的反应是吸热反应 |
| B、金属锂在常温和加热情况下与氧气反应的产物不同 |
| C、焰色反应实验中的铂丝应用稀盐酸洗涤 |
| D、铝箔在空气中受热熔化,并不滴落,说明铝与氧气没有发生化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、若甲为恒容体系,图象(Ⅰ)代表温度不同时,时间与B的体积分数关系图,则m>0 |
| B、恒温条件下,图象 (Ⅰ)可能代表压强不同时,时间与B的体积分数关系图 |
| C、恒温条件下,若甲、乙两容器体积相同,起始时分别向甲中充入2molA,乙中充入1molB、3molC,则达到平衡后两容器中B的体积分数一定不同 |
| D、恒温条件下,乙容器存在图象 (Ⅱ)的关系,则当x代表压强时,y可代表B的体积分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
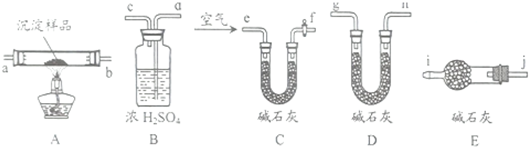
| 实验步骤 | 预期现象 | 结论 |
| ①称量B、D的质量分别为ml、m2,将装置按 f→a→b→ | ||
| ②称取一定质量的沉淀 | (1)若m1=m3,m2<m4 (2)若m1 m2 (3)若ml m2 | (1)假设1成立 (2)假设2成立 (3)假设3成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C4H6 |
| B、C3H4 |
| C、C3H6 |
| D、C2H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com