
| A. | O2 MnO2 KMnO4 | B. | KMnO4 MnO2O2 | ||
| C. | MnO2KMnO4 O2 | D. | O2 KMnO4 MnO2 |
分析 根据反应条件判断反应的难易程度,反应条件越少的氧化还原反应越容易发生,越容易发生的氧化还原反应氧化剂的氧化性越强,据此分析解答.
解答 解:根据方程式①4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O、②4HCl(g)+O2$\frac{\underline{催化剂}}{△}$2Cl2+2H2O(g)、③2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O知,③没有反应条件,①的反应条件是加热,②的反应条件是加热和催化剂,反应条件越少的氧化还原反应越容易发生,越容易发生的氧化还原反应氧化剂的氧化性越强,所以氧化性最强的是高锰酸钾,其次是二氧化锰,最后是氧气,
故选B.
点评 本题考查了氧化剂氧化性强弱的判断,根据“反应条件越少的氧化还原反应越容易发生,越容易发生的氧化还原反应氧化剂的氧化性越强”来解答即可,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | A+3B═C | B. | 2A+B═C | C. | A+3B═2C | D. | A+3B═3C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
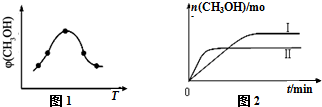
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 锰及其化合物有广泛应用.
锰及其化合物有广泛应用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑦ | B. | ②③⑥⑦ | C. | ④⑤⑥⑦ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
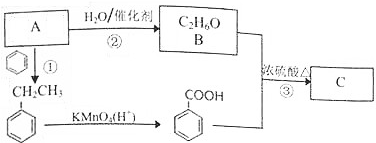
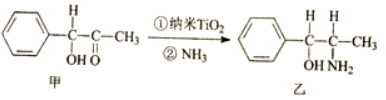
 +CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$
+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$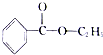 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
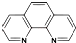 ),它能与Fe2+形成红色配合物(如图甲),该配离子中Fe2+与氮原子形成配位键共有6个.
),它能与Fe2+形成红色配合物(如图甲),该配离子中Fe2+与氮原子形成配位键共有6个.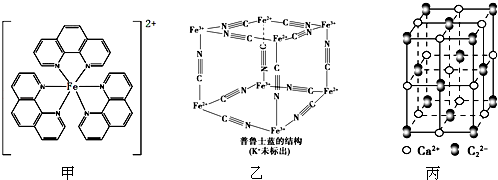
 ,其中σ键与π键数目之比为1:2.
,其中σ键与π键数目之比为1:2.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com