
| A. | 足量铁在氯气中反应,1mol铁失去的电子数为3NA | |
| B. | 6.4g Cu与足量硫充分反应后,转移电子数为0.2NA | |
| C. | 密闭容器中2mol NO与1mol O2充分反应后,产物的分子数为NA | |
| D. | 常温常压下,0.1mol NH3与0.1mol HCl充分反应后所得产物含0.1NA个分子 |
分析 A、铁和氯气反应后变为+3价;
B、求出铜的物质的量,然后根据铜和硫反应后变为+1价来分析;
C、NO和氧气反应后生成的NO2中存在平衡:2NO2?N2O4;
D、氨气和氯化氢反应后生成的氯化铵为离子晶体.
解答 解:A、铁和氯气反应后变为+3价,故1mol铁失去3mol电子即3NA个,故A正确;
B、6.4g铜的物质的量为0.1mol,而铜和硫反应后变为+1价,故0.1mol铜转移0.1NA个电子,故B错误;
C、NO和氧气反应后生成的NO2中存在平衡:2NO2?N2O4,导致分子个数减少,故小于NA个,故C错误;
D、氨气和氯化氢反应后生成的氯化铵为离子晶体,无分子,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
| 浓硫酸(H2SO4)500mL | |
| 浓度(质量分数) | 98% |
| 密度 | 1.81g•cm-3 |
| 相对分子质量 | 98 |
| 强腐蚀性,阴冷,密封贮藏 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 在通常情况下氯气比空气重 | |
| B. | 点燃是使氯气和氢气化合的唯一条件 | |
| C. | 氯气跟铁反应生成FeCl2 | |
| D. | 将红热的铜放入氯气中生成蓝色氯化铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的最简单氢化物比R的稳定,Y的最简单氢化物沸点比R的高 | |
| B. | X与Y形成的两种化合物中阴、阳离子的个数比均为1:2 | |
| C. | Z、W、R最高价氧化物对应水化物的酸性强弱顺序:R>W>Z | |
| D. | Y与Z两种元素组成常见ZY2型分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
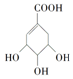 ,关于它的叙述中不正确的是( )
,关于它的叙述中不正确的是( )| A. | 该有机物能使溴的四氯化碳溶液褪色 | |
| B. | 该有机物发生消去反应可得到芳香烃 | |
| C. | 该有机物在一定条件下可发生氧化反应 | |
| D. | 1 mol该有机物最多可与1 mol NaHCO3反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 杂质 | 试剂 | 方法 | |
| A | 氯化铁溶液 | 氯化亚铁 | 过量铁粉 | 过滤 |
| B | 二氧化碳 | 二氧化硫 | 饱和NaHCO3溶液 | 洗气 |
| C | 二氧化硅 | 氧化铝 | 氨水 | 过滤 |
| D | 氯化钠溶液 | 碘化钠 | 四氯化碳 | 萃取 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
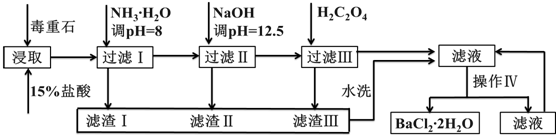
| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀的pH | 13.9 | 11.1 | 3.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com