
| A. | 投入铁片产生H2的溶液中可大量存在H+、Mg2+、SO42-、NO3- | |
| B. | 将过量二氧化硫气体入冷氨水中:SO2+NH3•H2O═HSO3-+NH4+ | |
| C. | 1.0mol•L-1的KNO3溶液中可大量存在H+、Fe2+、Cl-、SO42- | |
| D. | 硫化铜溶于硝酸的离子方程式为CuS+2H+═H2S↑+Cu2+ |
分析 A.投入铁片产生H2的溶液,为非氧化性酸溶液;
B.过量二氧化硫气体入冷氨水,反应生成亚硫酸氢铵;
C.离子之间发生氧化还原反应;
D.发生氧化还原反应.
解答 解:A.投入铁片产生H2的溶液,为非氧化性酸酸溶液中Fe、H+、NO3-反应不生成氢气,故A错误;
B.将过量二氧化硫气体入冷氨水中的离子反应为SO2+NH3•H2O═HSO3-+NH4+,故B正确;
C.H+、Fe2+、NO3-发生氧化还原反应,不能大量共存,故C错误;
D.硫化铜溶于硝酸,发生氧化还原反应,硫化铜溶于硝酸的离子方程式为3CuS+8NO3-+8H+═8NO↑+4H2O+3SO42-+3Cu2+,故D错误;
故选B.
点评 本题考查离子的共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应及分析与应用能力的考查,题目难度不大.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 聚丙烯的结构简式: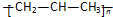 | B. | 二氧化碳的电子式: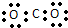 | ||
| C. | 中子数为18的硫原子:${\;}_{16}^{34}$S | D. | 乙醇的分子式:CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中国古代利用明矾的溶液的酸性清除铜镜表面的铜锈 | |
| B. | SO2可以用来漂白纸浆、毛、丝、草帽辫、增白食品等 | |
| C. | 14C可用于文物年代的鉴定,14C与12C互为同位素 | |
| D. | 喝补铁剂时,加服维生素C效果更好,原因是维生素C具有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阳离子只能得到电子被还原,作氧化剂 | |
| B. | 在金属活性顺序表中,Na排在Cu的前面,所以Na可与CuSO4溶液反应置换出单质Cu | |
| C. | 在氧化还原反应中,不一定所有元素的化合价都发生变化 | |
| D. | 氧化还原反应中,某元素由化合态变为游离态,此元素一定被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
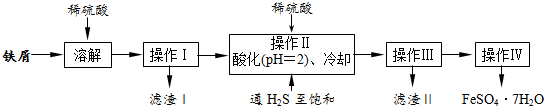
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Cu2+、NO3-、CO32- | B. | Mg2+、Na+、Cl-、SO42- | ||
| C. | Mg2+、NH4+、NO3-、CO32- | D. | NH4+、K+、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①②③ | C. | ①③⑤ | D. | ①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
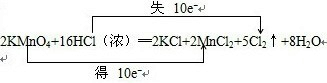 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com