
 A”¢B”¢C”¢D¾łĪŖ֊ѧ»Æѧ³£¼ūµÄ“æ¾»Īļ£¬AŹĒµ„ÖŹ£®ĖüĆĒÖ®¼äÓŠČēĻĀµÄ·“Ó¦¹ŲĻµ£ŗ
A”¢B”¢C”¢D¾łĪŖ֊ѧ»Æѧ³£¼ūµÄ“æ¾»Īļ£¬AŹĒµ„ÖŹ£®ĖüĆĒÖ®¼äÓŠČēĻĀµÄ·“Ó¦¹ŲĻµ£ŗ·ÖĪö £Ø1£©ČōAŹĒĮņ»Ē£¬BŹĒĘųĢ¬Ēā»ÆĪļ£¬ŌņBĪŖH2S£¬CŹĒŌģ³ÉĖįÓźµÄĪŪČ¾ĪļÖ®Ņ»£¬ŌņCĪŖSO2£¬¢Ü·“Ó¦ŹĒĶØŅ»ÖÖ»ĘĀĢÉ«ĘųĢåÓ¦ĪŖĀČĘų£¬Éś³ÉDŗĶĮķŅ»ÖÖ²śĪļE£¬DŹĒŅ»ÖÖŗ¬ŃõĖį£¬ĖłŅŌDŹĒĮņĖį£¬EĪŖĀČ»ÆĒā£¬ŅĄ¾ŻĶʶĻ³öµÄĪļÖŹŹéŠ“»Æѧ·½³ĢŹ½£»
£Ø2£©ČōDĪļÖŹ¾ßÓŠĮ½ŠŌĶʶĻDĪŖAl£ØOH£©3£¬¢Ü·“Ó¦ŹĒĶØČė¹żĮæµÄŅ»ÖÖŅżĘšĪĀŹŅŠ§Ó¦µÄÖ÷ŅŖĘųĢ壬ĖµĆ÷CĪŖĘ«ĀĮĖįÄĘNaAlO2£¬¢Ś¢Ū·“Ó¦¾łŅŖÓĆĒæ¼īČÜŅŗ£¬ÅŠ¶ĻAĪŖAl£¬BĪŖAlCl3£¬ŅĄ¾ŻĶʶĻ³öµÄĪļÖŹÅŠ¶Ļ£»
£Ø3£©ČōAŹĒÓ¦ÓĆ×ī¹ć·ŗµÄ½šŹō£®ĶʶĻĪŖFe£¬¢Ü·“Ó¦ÓƵ½A£¬¢Ś¢Ż·“Ó¦¾łÓƵ½Ķ¬Ņ»ÖÖ·Ē½šŹōµ„ÖŹ£®ĶʶĻĪŖCl2£¬CµÄČÜŅŗÓĆÓŚŹ“æĢÓ”Ė¢ĶµēĀ·°å£¬ÅŠ¶ĻCĪŖFeCl3£¬DĪŖFeCl2£®
½ā“š ½ā£ŗ£Ø1£©ČōAŹĒĮņ»Ē£¬BŹĒĘųĢ¬Ēā»ÆĪļ£¬ŌņBĪŖH2S£¬CŹĒŌģ³ÉĖįÓźµÄĪŪČ¾ĪļÖ®Ņ»£¬ŌņCĪŖSO2£¬¢Ü·“Ó¦ŹĒĶØŅ»ÖÖ»ĘĀĢÉ«ĘųĢåÓ¦ĪŖĀČĘų£¬Éś³ÉDŗĶĮķŅ»ÖÖ²śĪļE£¬DŹĒŅ»ÖÖŗ¬ŃõĖį£¬ĖłŅŌDŹĒĮņĖį£¬EĪŖĀČ»ÆĒā£¬¢ÜµÄ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖCl2+SO2+2H2O=2HCl+H2SO4£¬¼ģŃéĀČĄė×ÓĖłÓĆŹŌ¼ĮĪŖĻõĖįĖį»ÆµÄĻõĖįŅų£¬
¹Ź“š°øĪŖ£ŗCl2+SO2+2H2O=2HCl+H2SO4£»ĻõĖįĖį»ÆµÄĻõĖįŅų£»
£Ø2£©ČōDĪļÖŹ¾ßÓŠĮ½ŠŌĶʶĻDĪŖAl£ØOH£©3£¬¢Ü·“Ó¦ŹĒĶØČė¹żĮæµÄŅ»ÖÖŅżĘšĪĀŹŅŠ§Ó¦µÄÖ÷ŅŖĘųĢ壬ĖµĆ÷CĪŖĘ«ĀĮĖįÄĘNaAlO2£¬¢Ś¢Ū·“Ó¦¾łŅŖÓĆĒæ¼īČÜŅŗ£¬ÅŠ¶ĻAĪŖAl£¬BĪŖAlCl3£¬µ„ÖŹAĪŖAl£¬ŌŖĖŲŌŚÖÜĘŚ±ķÖŠµÄĪ»ÖĆŹĒµŚČżÖÜĘŚ¢óA×壬¢Ü·“Ó¦Ąė×Ó·½³ĢŹ½£ŗAlO2-+2H2O+CO2ØTAl£ØOH£©3”ż+HCO3-£¬ÓĆĀĮ»¹Ō½šŹōŃõ»ÆĪļ¼“ĀĮČČ·“Ó¦£¬ĄżČē2Al+Fe2O3$\frac{\underline{\;øßĪĀ\;}}{\;}$Al2O3+2Fe£¬
¹Ź“š°øĪŖ£ŗAlO2-+2H2O+CO2ØTAl£ØOH£©3”ż+HCO3-£»2Al+Fe2O3$\frac{\underline{\;øßĪĀ\;}}{\;}$Al2O3+2Fe£»
£Ø3£©ČōAŹĒÓ¦ÓĆ×ī¹ć·ŗµÄ½šŹō£®ĶʶĻĪŖFe£¬¢Ü·“Ó¦ÓƵ½A£¬¢Ś¢Ż·“Ó¦¾łÓƵ½Ķ¬Ņ»ÖÖ·Ē½šŹōµ„ÖŹ£®ĶʶĻĪŖCl2£¬CµÄČÜŅŗÓĆÓŚŹ“æĢÓ”Ė¢ĶµēĀ·°å£¬ÅŠ¶ĻCĪŖFeCl3£¬DĪŖFeCl2£¬CµÄČÜŅŗÓĆÓŚŹ“æĢÓ”Ė¢ĶµēĀ·°å£¬Š“øĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗCu+2Fe3+=Cu2++2Fe2+£¬
¹Ź“š°øĪŖ£ŗCu+2Fe3+=Cu2++2Fe2+£®
µćĘĄ ±¾Ģāæ¼²éĮĖĪļÖŹ×Ŗ»Æ¹ŲĻµµÄÓ¦ÓĆŗĶŠŌÖŹÓ¦ÓĆ£¬Ö÷ŅŖæ¼²éĮņ¼°Ęä»ÆŗĻĪļŠŌÖŹ”¢µŖ¼°Ęä»ÆŗĻĪļ”¢¹č¼°Ęä»ÆŗĻĪļ”¢Ģś¼°Ęä»ÆŗĻĪļŠŌÖŹµÄ×ŪŗĻÓ¦ÓĆ£¬ÓĆŗĆĢõ¼žŹĒ½āĢā¹Ų¼ü£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¢Ł¢Ś¢Ż¢ß | B£® | ¢Ł¢Ū¢Ü¢Ż¢Ž | C£® | ¢Ł¢Ū¢Ż¢Ž¢ß | D£® | Č«²æ¶¼ÓŠ¹Ų |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

| Ź±¼ä/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n£ØO2£©/mol | 0.7 | 0.4 | 0.3 | x | x | x |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
 µ½ÄæĒ°ĪŖÖ¹£¬ÓÉ»ÆѧÄÜ×Ŗ±äµÄČČÄÜ»ņµēÄÜČŌČ»ŹĒČĖĄąŹ¹ÓƵÄ×īÖ÷ŅŖµÄÄÜŌ“£®
µ½ÄæĒ°ĪŖÖ¹£¬ÓÉ»ÆѧÄÜ×Ŗ±äµÄČČÄÜ»ņµēÄÜČŌČ»ŹĒČĖĄąŹ¹ÓƵÄ×īÖ÷ŅŖµÄÄÜŌ“£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

| Ö÷ŅŖ³É·Ö | Cu | Ag | Au | Se | Te |
| °Ł·Öŗ¬Įæ/% | 23.4 | 12.1 | 0.9 | 6.7 | 3.1 |
| ¹Ģ¶Ø½ž³öĪĀ¶Č | ¹Ģ¶ØH2SO4ÅØ¶Č | |||||||||||
| H2SO4ÅضČ/mol•L-1 | ½ž³öĀŹ/% | ½ž³öĪĀ¶Č/”ę | ½ž³öĀŹ/% | |||||||||
| Cu | Ag | Au | Se | Te | Cu | Ag | Au | Se | Te | |||
| 4 | 95.1 | 4.67 | £¼0.2 | 0.83 | 8.93 | 30 | 87.1 | 4.58 | £¼0.2 | 0.08 | 6.83 | |
| 3 | 94.5 | 4.65 | £¼0.2 | 0.28 | 6.90 | 40 | 94.5 | 4.65 | £¼0.2 | 0.28 | 6.90 | |
| 2 | 78.1 | 2.65 | £¼0.2 | 0.05 | 2.85 | 50 | 96.1 | 5.90 | £¼0.2 | 0.64 | 8.73 | |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® |  ½ųŠŠÅēČŖŹµŃé | B£® | 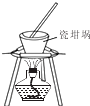 ¼ÓČČČŪČŚ£ØNaOH£© | ||
| C£® |  ŃéÖ¤Ć¾Ę¬ÓėĻ”ŃĪĖį·“Ó¦·ÅČČ | D£® | 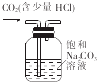 ³żČ„CO2ÖŠµÄÉŁĮæHCl |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŌŚ1L 0.1mol/LµÄĢ¼ĖįÄĘČÜŅŗÖŠ£¬ŃõŌ×Ó×ÜŹżĪŖ0.3 NA | |
| B£® | 1molAl3+ĶźČ«Ė®½āÉś³ÉĒāŃõ»ÆĀĮ½ŗĢåĮ£×ӵďżÄæĪŖNA | |
| C£® | ³£ĪĀ³£Ń¹ĻĀ£¬32gO${\;}_{2}^{-}$ÖŠĖłŗ¬µē×ӵďżÄæĪŖ17NA | |
| D£® | ±ź×¼×“æöĻĀ£¬11.2 L±½ÖŠŗ¬ÓŠ·Ö×ӵďżÄæĪŖ0.5 NA |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com