
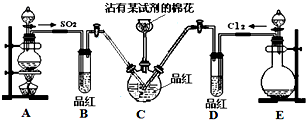
 探究SO2和氯水的漂白性,设计了如下实验,装置如图.
探究SO2和氯水的漂白性,设计了如下实验,装置如图.分析 探究SO2和氯水的漂白性:A用于制备SO2,可用Na2SO3与硫酸反应制取,B用于检验二氧化硫的生成,E用浓盐酸和二氧化锰在加热条件下制备氯气,D用于检验气体的漂白性,C用于检验SO2和氯水都有漂白性,二者混合后的漂白性,棉花上沾有的试剂是NaOH溶液,作用是吸收尾气.
(1)氯气、二氧化硫都是污染性的气体不能排放到空气中,棉花需要沾有氢氧化钠溶液吸收氯气、二氧化硫气体;
(2)①氯气和二氧化硫都能使品红溶液褪色;②二氧化硫的漂白具有不稳定性,氯气的漂白具有不可逆性;
(3)SO2和Cl2按1:1通入,SO2和Cl2恰好反应,二者反应生成H2SO4和HCl,生成物都无漂白性;
(4)常温下和浓盐酸反应生成氯气的物质常用高锰酸钾,根据氯原子守恒及化合价变化可知,氯气中氯原子的物质的量即为被氧化的HCl的物质的量;
(5)根据亚硫酸根离子和硝酸的性质分析,硝酸有强氧化性,能把亚硫酸根离子氧化成硫酸根离子.
解答 解:(1)氯气、二氧化硫都是污染性的气体不能排放到空气中,氯气和氢氧化钠发应生成氯化钠、次氯酸钠和水,二氧化硫和氢氧化钠反应生成亚硫酸钠和水,棉花需要沾有氢氧化钠溶液吸收吸收Cl2或SO2等尾气,保护环境,
故答案为:吸收Cl2或SO2等尾气,保护环境;
(2)①氯气和水反应生成的次氯酸具有漂白性,二氧化硫和品红化合生成无色物质,两者都能使品红溶液褪色,所以B和D装置中品红都褪色,
故答案为:品红溶液褪色;品红溶液褪色;
②二氧化硫漂白后的物质具有不稳定性,加热时又能变为红色,而氯气的漂白是利用了氯气和水反应生成的次氯酸的强氧化性,具有不可逆性,
所以看到的现象是B中溶液由无色变为红色,D中无明显现象,
故答案为:褪色的品红又恢复为红色;无明显现象;
(3)SO2和Cl2按1:1通入,SO2和Cl2恰好反应,二者反应生成H2SO4和HCl,生成物都无漂白性,化学方程式为:SO2+Cl2+2H2O=H2SO4+2HCl;
故答案为:SO2+Cl2+2H2O=H2SO4+2HCl;
(4)常温下,用KMnO4和浓盐酸反应制Cl2,反应的化学方程式如下:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,Mn元素由+7价降低到+2价,Cl元素的化合价由-1价升高到0,高锰酸钾得电子是氧化剂,HCl失电子是还原剂,2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,每生成5mol氯气被氧化的HCl是10mol,生成2.24L(标准状况)的Cl2,为0.1mol氯气,所以被氧化的HCl的物质的量n=2n(Cl2)=2×0.1mol=0.2mol,
故答案为:KMnO4;0.2;
(5)亚硫酸根离子具有还原性,硝酸具有氧化性,能把亚硫酸根离子氧化成硫酸根离子,蘸有试剂的棉花中可能含有SO32-,用HNO3溶液酸化时会干扰SO42-检验,所以该方案不合理,
故答案为:不合理;蘸有试剂的棉花中可能含有SO32-,用HNO3溶液酸化时会干扰SO42-检验.
点评 本题考查物质的性质实验,侧重于学生的分析、实验能力的考查,题目涉及二氧化硫与氯气的制取以及二氧化硫漂白与次氯酸漂白的区别,题目难度中等.


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:解答题
| 官能团 | 选择试剂 | 实验现象 | 有关反应的化学方程式或离子方程式 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| pH t/min T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是N2(g)+3H2(g)═2NH3(g)在反应过程中的反应速率v与时间(t)的关系曲线,下列说法错误的是( )
如图是N2(g)+3H2(g)═2NH3(g)在反应过程中的反应速率v与时间(t)的关系曲线,下列说法错误的是( )| A. | t1时,正方向速率大于逆反应速率 | |
| B. | t2时,反应体系中NH3的浓度达到最大值 | |
| C. | t2-t3时间段,正反应速率等于逆反应速率 | |
| D. | t2-t3时间段,各物质的浓度相等且不再发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
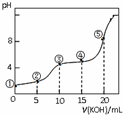 常温下,用0.05mol•L-1 KOH溶液滴定 10.00mL0.05mol•L-1 H2C2O4(二元弱酸)溶液所得滴定曲线如图(体积变化忽略不计).下列说法错误的是( )
常温下,用0.05mol•L-1 KOH溶液滴定 10.00mL0.05mol•L-1 H2C2O4(二元弱酸)溶液所得滴定曲线如图(体积变化忽略不计).下列说法错误的是( )| A. | 点②溶液中:c(K+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-) | |
| B. | 点③溶液中:c(K+)=c(HC2O4-)+c(C2O42-)+c(H2C2O4) | |
| C. | 点④溶液中:c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.05 mol•L-1 | |
| D. | 点⑤溶液中:c(K+)>c(HC2O4-)>c(C2O42-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 阴离子和Ba(NO3)2反应生成不溶于盐酸的白色沉淀.D的浓溶液与KMnO4混合,生成的气体能使石蕊溶液褪色,A的水溶液显酸性.用化学式表示A、B、C、D、E各是什么物质.写出有关化学方程式.
阴离子和Ba(NO3)2反应生成不溶于盐酸的白色沉淀.D的浓溶液与KMnO4混合,生成的气体能使石蕊溶液褪色,A的水溶液显酸性.用化学式表示A、B、C、D、E各是什么物质.写出有关化学方程式.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
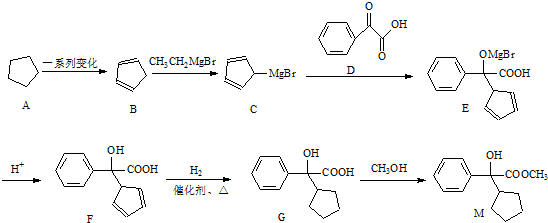
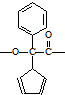
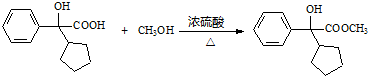 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com