
����Ŀ���ں����ܱ�������ͨ��X��������Ӧ��2X��g��Y��g�����¶�T1��T2��X�����ʵ���Ũ��c��X����ʱ��t�仯��������ͼ��ʾ������������ȷ���ǣ������� 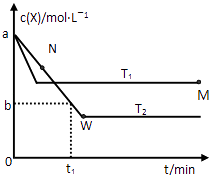
A.�÷�Ӧ���е�M��ų����������ڽ��е�W��ų�������
B.T2�£���0��t1ʱ���ڣ�v��Y��= ![]() molL��1min��1
molL��1min��1
C.M�������Ӧ����V������N����淴Ӧ����V��
D.M��ʱ�ټ���һ����X��ƽ���X��ת���ʼ�С
���𰸡�C
����������ͼ��֪���¶�ΪT1�ȵ���ƽ�⣬����T1��T2���¶�Խ�ߣ�ƽ��ʱX�����ʵ���Ũ��Խ��˵�������¶�ƽ�����淴Ӧ�ƶ��������¶�ƽ�������ȷ�Ӧ�ƶ������淴ӦΪ���ȷ�Ӧ������ӦΪ���ȷ�Ӧ��
A������ͼ���жϲμӷ�Ӧ��X�����Ķ��٣���Ӧ��XԽ�࣬����Խ�ࣻ
B������ͼ��X��Ũ�ȱ仯���Y��Ũ�ȱ仯������Ӧ���ʣ�
C���¶�Խ�߷�Ӧ����Խ��
D��M��ʱ�ټ���һ����X���ﵽ����ƽ����ԭƽ��Ƚϣ�����ѹǿ��ƽ���Ӱ�������
�⣺��ͼ��֪���¶�ΪT1�ȵ���ƽ�⣬����T1��T2���¶�Խ�ߣ�ƽ��ʱX�����ʵ���Ũ��Խ��˵�������¶�ƽ�����淴Ӧ�ƶ��������¶�ƽ�������ȷ�Ӧ�ƶ������淴ӦΪ���ȷ�Ӧ������ӦΪ���ȷ�Ӧ��
A�����е�M��X��ת���ʽϵͣ����������Ƿ��ȷ�Ӧ�����Է�Ӧ���е�M��ų��������٣���A����
B��T2�£���0��t1ʱ���ڣ�X��Ũ�ȱ仯Ϊ��c��X��=��a��b��mol/L����Y��Ũ�ȱ仯Ϊc��Y��= ![]() c��X��=
c��X��= ![]() mol/L������v��Y��=
mol/L������v��Y��= ![]() molL��1min��1����B����
molL��1min��1����B����
C������ͼ���֪���¶�ΪT1ʱ��Ӧ���ȴﵽƽ��״̬���¶ȸ߷�Ӧ���ʿ죬����ƽ���ʱ���٣����¶���T1��T2��M���¶ȸ���N���¶ȣ���N�㷴Ӧû�дﵽƽ��״̬����ʱ��Ӧ������Ӧ������У���N����淴Ӧ����С��N�������Ӧ���ʣ����M�������Ӧ���ʴ���N����淴Ӧ���ʣ���C��ȷ��
D��M��ʱ�ټ���һ����X���ﵽ����ƽ����ԭƽ��Ƚϣ�ѹǿ��������ѹǿƽ�����ƣ���X��ת������������M��ʱ�ټ���һ����X��ƽ���X��ת��������D����
��ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ǧ���仯����������������ܺ㷺��Ӧ�á���ҵ������Ǧ����(��Ҫ�ɷ���PbO��Pb��������������Ag��CaO)�Ʊ�����Ǧ���Ʊ�����ͼ����
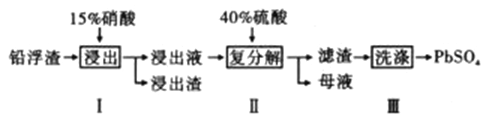
��֪��Ksp(PbSO4)=1.6��10-8 Ksp(CaSO4)=4.9��10-5
(1)����I��NO��������Һ�к������Ľ���������ΪPb2+��д��Pb�μӷ�Ӧ�Ļ�ѧ����ʽ___________________________��Ϊ��ֹAg���ܽ������Һ������I����ʱӦע��_______________________��
(2)��PbSO4��Ʒ���е�������____________��Ҫ�õ�������PbSO4����Ҫ���Լ����ж��ϴ�ӣ���������ˮϴ�ӡ����ѡ�õ��Լ���_________________��
A.ϡ���� B.ϡ���� C.����Ǧ��Һ D.�ƾ�
(3)ĸҺ��ѭ�����õ�������HNO3����ĸҺ�в�����SO42-���࣬ѭ������ʱ���ܳ��ֵ�������______________________________��
(4)����������е�Pb2+��ȫ����������Һ�е�c(SO42-)����Ϊ___________mol/L��
(5)(CH3COO)2Pb��Ƥë��ҵ������ˮ��Ⱦɫ����������PbSO4��CH3 COONH4��Ӧ�Ʊ���д���÷�Ӧ�����ӷ���ʽ_______________________��
(6)Ǧ�����ǵ�ѹ�ȶ���ʹ�÷���Ķ��ε�ء�PbSO4�����а�������Ҫ��ɫ��д��Ǧ���س��ʱ�����ĵ缫��Ӧ_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������(NH4ClO4)Ϊ��ɫ���壬��ǿ�����������������������ƽ�������֪:��NH4ClO4��400��ʱ��ʼ�ֽ⣬����ΪN2��Cl2��O2��H2O����Mg3N2��ˮ�⡣������ͼ��ʾװ�����ʵ��֤���ֽ�����к���Cl2��H2O�Լ�װ��A��������Mg3N2(װ�ò��ظ�ʹ��)��
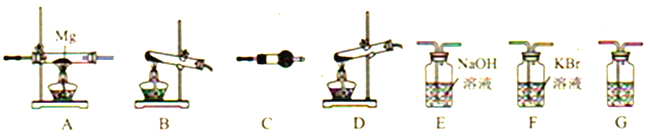
��1��д��������立ֽ�Ļ�ѧ����ʽ__________��
��2��������立ֽ�ѡ���װ����__________(����ĸ)��
��3�������������ң�װ�õ�����˳����:�ֽ�װ����_____��_____��_____��_____��_____��______________
��4��C�����ŵ��Լ���__________��G��������__________ ��
��5����֤����Cl2������������__________��
��6��Ҫ֤��װ��A��������Mg3N2��Ҫ���е�ʵ������Լ���Ӧ��ʵ��������__________��
��7��ijʵ������ŵĸ��������Ʒ�к����������ʣ���֪�������ⶨNH4ClO4�ĺ�������ⶨ��������(���ʲ��μӷ�Ӧ)������Ʒ��NH4ClO4�ĺ���(w)Ϊ__________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ���У����Ը�����ijЩ��ѧ�Լ�����������ɫ��Ӧ�����������֯�е��й��л�������Ĵ��ڡ�������ʵ���б��У���ȷ����(����)
ѡ�� | ���������� | ʹ���Լ� | ������ɫ |
A | ƻ���еĻ�ԭ�� | ����Լ� | �ٻ�ɫ |
B | �������еĵ��� | ˫�����Լ� | ��ɫ |
C | ������֬�� | �յ���ȾҺ | �ٻ�ɫ |
D | ���еĵ����� | ����Լ� | ��ɫ |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ԫ������������Ƶ�һ����
A. ��ԭ���ȵ���
B. ��ά�ء�θ����ø
C. RNA������
D. DNA����֬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������仯��������Ҫ�Ͻ���Ϻʹ������䴢��Ͻ����Ϊһ������п���ӵ�صĸ������ϣ��õ����Zn(CF3SO3)2Ϊ����ʣ�����ȱ�ݵ���������ZnMn2O4Ϊ�缫���ɹ�������ȶ��Ĵ��ʵ�����
��1����̬��ԭ�ӵĺ�������Ų�ʽΪ________�����Ų�ʱ������ߵ�����ռ���ܼ���ԭ�ӹ����________����չ����
��2��VO2+������������γ���������ͬ�����ҵ�һ�����ܱ����������Ԫ����____(дԪ�ط���)��
��3�����γɵ�������[Ni��NH3��6]2+��[Ni(CN)4]2-�У�NH3���ӵĿռ乹��Ϊ_______����CN-��Ϊ�ȵ������һ�ַ��ӵĻ�ѧʽΪ__________��
��4����������(CF3SO3H)��һ���л�ǿ�ᣬ�ṹʽ��ͼ1��ʾ��ͨ����CS2��IF3��H2O2��Ϊ��Ҫԭ������ȡ��
��H2O2������Oԭ�ӵ��ӻ���ʽΪ________��
��������������ⱽ��Ӧ�����������ᱽ���͵⻯�⡣1���������ᱽ�������к�����������ĿΪ__________��

��5����п����Ĺ����ж��֣�����һ����п�ľ�����ͼ2��ʾ���þ�����S2-����λ��Ϊ____��
��6�������Ͻ�����Ҫ������ϣ��䴢���ľ�����ͼ3��ʾ��
�ٴ���ǰ�������Ͻ�Ļ�ѧʽΪ___________��
�ڸ������Ͻ�����������ܶ�Ϊ________(��NA��ʾ�����ӵ���������ֵ)g.cm-3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵������ȷ������ ��
A. 1.7g�ǻ�����������ĿΪNA
B. 1L 1mol/L�ļ״�ˮ��Һ�к�����ԭ������Ϊ4NA
C. 28 g����ϩ���е�̼ԭ����Ϊ2nNA
D. ���³�ѹ�£�3.0g�����Ǻͱ�����Ļ�����к��е�ԭ������Ϊ0.4NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���̷�(FeSO4��7H2O)������ԭ������ɫ������ҩ�ȣ��ڲ�ͬ�¶����ֽ�ø������������������������֪SO3��һ����ɫ���壬�۵�16.8�棬�е�44.8�棬�����Լ���ˮ�Խ�Ũ����ǿ��������Ũ���ᣬ��Ư��ijЩ�л�Ⱦ�ϣ���Ʒ��ȡ��ش���������:

(1)����ͬѧ������ͼ��ʾװ�ã�ͨ��ʵ������̷��ֽ���װ��B�пɹ۲쵽��������______________________________�������ɴ˵ó��̷��ķֽ�����к���SO2��
(2)����ͬѧ��Ϊ����ʵ����۲��Ͻ����Լ���ͬѧ����ʵ���Bװ�õ��Թܼ��ȣ�������ɫ��Ʒ����Һδ�ָ���ɫ�����֤���̷��ֽ�IJ�����____________(����ĸ)��
A.����SO2 B.���ܺ�SO2 C.һ������SO3
(3)����ͬѧ�������Ϸ����̷����ȷֽ������O2�ų���Ϊ�ˣ�����ͬѧѡ�ü���ͬѧ�IJ���ʵ��װ�ü�����װ��������װ�����̷��ֽ�������̬������н�һ����֤: 
��װ��F��������������______________________��
�ڱ���ͬѧ��ʵ��װ���У��������ӵĺ���˳��ΪA��F��____��____��____��D��H(ÿ������ֻ��ʹ��һ��)����ʵ������У�SO3�Ժ��������ⲻ�������ŵ�������____________��
��ʵ����ɺ�A�Թ��в����ĺ�ɫ������_________����֤���̷��ֽ��������O2�ļ��鷽����______________________________________________________��
����֪ʵ��ǰװ��A�Թ�����ȡ���̷�������mg������һ��ʱ��������Թ��м���������ϡ���ᣬ����Ũ��Ϊc mol/L��KMnO4��Һ�ζ�������ζ��յ�ʱ������KMnO4��Һ�����ΪVmL�����̷����ȷֽ�����У���Ԫ�ر������İٷ���Ϊ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NH4Al��SO4��2��ʳƷ�ӹ�����Ϊ��ݵ�ʳƷ���Ӽ������ڱ���ʳƷ��NH4HSO4�ڷ����Լ���ҽҩ�����ӹ�ҵ����;�㷺����ش��������⣺
��1����ͬ�����£�0.1molL��1��NH4Al��SO4��2��c��NH4+��������ڡ��������ڡ���С�ڡ���0.1molL��1NH4HSO4��c��NH4+����
��2����Ϊ0.1molL��1�ļ��ֵ������Һ��pH���¶ȱ仯��������ͼ1��ʾ�� 
�����з���0.1molL��1NH4Al��SO4��2��pH���¶ȱ仯�������� �� ����pH���¶ȱ仯��ԭ������
��20��ʱ��0.1molL��1��NH4Al��SO4��2��2c��SO42������c��NH4+����3c��Al3+��=��ȡ����ֵ��
��3������ʱ����100mL0.1molL��1NH4HSO4��Һ�еμ�0.1molL��1NaOH��Һ����ҺpH��NaOH��Һ����Ĺ�ϵ������ͼ2��ʾ�� �Է���ͼ��a��b��c��d�ĸ��㣬ˮ�ĵ���̶��������㣻��b�㣬��Һ�и�����Ũ���ɴ�С������˳���� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com