
分析 氢氧化钡与硫酸反应生成硫酸钡和水;
氢氧化铁与盐酸的反应生成氯化铁和水;
Mg2++2OH-═Mg(OH)2↓,表示可溶性镁盐和强碱反应生成氢氧化镁沉淀和可溶性盐;
HCO3-+H+═CO2↑+H2O表示可溶性碳酸氢盐和强酸反应生成可溶性盐和二氧化碳、水.
解答 解:稀硫酸为二元强酸,氢氧化钡为二元强碱,二者反应生成硫酸钡沉淀和水,反应的离子方程式为2H++2OH-+SO42-+Ba2+=BaSO4↓+2H2O,
故答案为:2H++2OH-+SO42-+Ba2+=BaSO4↓+2H2O;
氢氧化铁与盐酸的反应生成氯化铁和水,离子方程式:Fe(OH)3+3H+=Fe3++3H2O;
故答案为:Fe(OH)3+3H+=Fe3++3H2O;
Mg2++2OH-═Mg(OH)2↓,表示可溶性镁盐和强碱反应生成氢氧化镁沉淀和可溶性盐,可以表示氯化镁与氢氧化钠反应,方程式:MgCl2+2NaOH=Mg(OH)2↓+2NaCl;
故答案为:MgCl2+2NaOH=Mg(OH)2↓+2NaCl;
HCO3-+H+═CO2↑+H2O表示可溶性碳酸氢盐和强酸反应生成可溶性盐和二氧化碳、水,可表示碳酸氢钠与盐酸反应,方程式:NaHCO3+HCl=NaCl+CO2↑+H2O,
故答案为:NaHCO3+HCl=NaCl+CO2↑+H2O.
点评 本题考查离子反应方程式和化学反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应的离子反应考查,注意离子方程式的意义,(2)中答案不唯一,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 钢铁制品的腐蚀常以析氢腐蚀为主 | |
| B. | 厨房中常用碳酸钠溶液洗涤餐具上的油污 | |
| C. | 明矾[KAl(SO4)2•12H2O]用于水的杀菌消毒 | |
| D. | 新型材料聚酯纤维、光导纤维都属于有机高分子材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | H2C2O4溶液 | KMnO4溶液 | 温度 |
| Ⅰ | 20mL 0.2mol•L-1 | 30mL 0.01mol•L-1 | 25℃ |
| Ⅱ | 20mL 0.1mol•L-1 | 30mL 0.01mol•L-1 | 25℃ |
| Ⅲ | 20mL 0.2mol•L-1 | 30mL 0.01mol•L-1 | 50℃ |
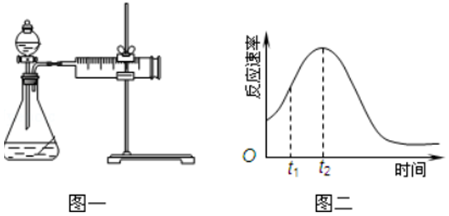
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
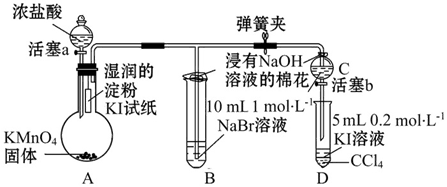
 ,在该反应中浓盐酸表现了还原性和酸性.
,在该反应中浓盐酸表现了还原性和酸性.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤ | B. | ②③④⑥ | C. | ③④⑤⑥ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图,图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度间相差1mL,图II表示50mL滴定管中液面的位置,D 与E刻度间相差1mL.如果刻度A和D都是10,则两处液面的读数是( )
如图,图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度间相差1mL,图II表示50mL滴定管中液面的位置,D 与E刻度间相差1mL.如果刻度A和D都是10,则两处液面的读数是( )| A. | Ⅰ中是9.2mL,Ⅱ中是9.40mL | B. | Ⅰ中是10.8mL,Ⅱ中是9.40mL | ||
| C. | Ⅰ中是10.8mL,Ⅱ中是10.60mL | D. | Ⅰ中是9.2mL,Ⅱ中是10.60mL |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com