
(16分)雾霾天气严重影响人们的生活质量,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一。消除氮氧化物和硫氧化物有多种方法。
(1)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图31-1所示:


①由图31-1可知SCR技术中的氧化剂为: 。
②图31-2是不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知最佳的催化剂和相应的温度分别为: 、 。
③用Fe做催化剂时,在氨气足量的情况下,不同c(NO2)/c(NO)对应的脱氮率如图31-3所示,脱氮效果最佳的c(NO2)/c(NO)= 。已知生成1molN2反应放出的热量为QkJ,此时对应的脱氮反应的热化学方程式为 。

(2)利用喷雾干燥法脱硫工艺是除去SO2的常见方法,先将含SO2的废气溶于水,再用饱和石灰浆吸收,具体步骤如下:
SO2(g)+H2O(l) H2SO3(l)
H2SO3(l) H+(aq)+HSO3—(aq) I
H+(aq)+HSO3—(aq) I
HSO3—(aq) H+(aq)+SO32—(aq) II
H+(aq)+SO32—(aq) II
Ca(OH)2(s) Ca2+(aq)+2OH—(aq) III
Ca2+(aq)+2OH—(aq) III
Ca2+(aq)+SO32—(aq) CaSO3(s) IV
CaSO3(s) IV
④步骤II的平衡常数K的表达式为 。
⑤该温度下,吸收液中c(Ca2+)一直保持为0.70mol/L,已知Ksp(CaSO3)=1.4×10-7,则吸收后溶液中的SO32-的浓度。(写出计算过程,保留2位有效数字)
(1)① NO、NO2 (2分) ② Mn (2分) 200-250℃或范围内间任意温度(2分)
③1:1 (2分) 2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2O(g) ΔH=-2QkJ/mol (3分)
2N2(g)+3H2O(g) ΔH=-2QkJ/mol (3分)
(2) ④K= (2分)
(2分)
⑤c(SO32-)= mol/L=2×10-7mol/L(3分)
mol/L=2×10-7mol/L(3分)
【解析】
试题分析:(1)①根据反应前后元素化合价变化可知,氨气中氮元素的化合价从-3价升高到0价,失去电子被氧化做还原剂;氮氧化合中氮元素的化合价降低,得到电子被还原做氧化剂,因此氧化剂是NO、NO2。
②根据图像可知,两种催化剂的脱氮率几乎是相同的,但Mn所在曲线的温度低,所以由图可知最佳的催化剂和相应的温度分别为Mn和200~250℃或范围内间任意温度。
③根据图像可知c(NO2)/c(NO)=1:1是脱氮率最高,由于每生成1molN2反应放出的热量为QkJ,所以此时对应的脱氮反应的热化学方程式为2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2O(g) ΔH=-2QkJ/mol。
2N2(g)+3H2O(g) ΔH=-2QkJ/mol。
(2) ④化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据化学方程式可知,该反应的平衡常数表达式K= 。
。
⑤根据硫酸钙的溶度积常数表达式Ksp(CaSO3)=c(Ca2+)·c(SO32-)可知,c(SO32-)= mol/L=2×10-7mol/L。
mol/L=2×10-7mol/L。
考点:考查氧化还原反应、外界条件对平衡状态的影响、平衡常数以及溶度积常数的有关计算


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案科目:高中化学 来源:2013-2014广东省惠州市高一下学期期末考试化学(理)试卷(解析版) 题型:选择题
元素周期表中,划分周期的依据是
A.元素的核电荷数 B.元素原子的电子层数
C.元素的化合价 D.元素原子的最外层电子数
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省广州市毕业班综合测试三 理综化学试卷(解析版) 题型:选择题
下列离子方程式错误的是
A.Fe(OH)2溶液中加入HNO3溶液:Fe(OH)2+2H+=2H2O+Fe2+
B.盐酸除去铜器表面的铜绿:Cu2(OH)2CO3+4H+=3H2O+2Cu2++CO2↑
C.氯气可以降低的SO2的漂白性:SO2+Cl2+2H2O=2Cl—+4H++SO42—
D.CO2通入饱和碳酸钠溶液:CO2+ CO32—+2Na++H2O=2NaHCO3↓
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省高三5月综合测试理综化学试卷(解析版) 题型:填空题
(16分)化学反应的能量变化、速率、限度是化学研究的重要内容。
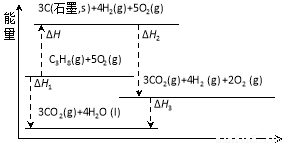
(1)有关研究需要得到C3H8(g) = 3C(石墨,s) + 4H2(g)的ΔH,但测定实验难进行。设计下图可计算得到:
①ΔH 0(填>、<或=)
②ΔH =
(用图中其它反应的反应热表示)
(2)甲酸、甲醇、甲酸甲酯是重要化工原料。它们的一些性质如下:
物质 | HCOOH | CH3OH | HCOOCH3 |
主要 性质 | 无色液体,与水互溶 K(HCOOH)>K(CH3COOH) | 无色液体,与水互溶 | 无色液体,在水中溶解度小,与醇互溶 |
工业制备甲酸原理:HCOOCH3(l) + H2O(l) 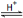 HCOOH(l) + CH3OH(l),反应吸热,但焓变的值很小。常温常压下,水解反应速率和平衡常数都较小。
HCOOH(l) + CH3OH(l),反应吸热,但焓变的值很小。常温常压下,水解反应速率和平衡常数都较小。
①工业生产中,反应起始,在甲酸甲酯和水的混合物中加入少量甲酸和甲醇,从反应速率和限度的角度分析所加甲酸和甲醇对甲酸甲酯水解的影响。
甲醇: 。
甲酸: 。
某小组通过试验研究反应HCOOCH3转化率随时间变化的趋势,在温度T1下,采用酯水比为1:2进行实验,测得平衡是HCOOCH3的转化率为25%。
②预测HCOOCH3转化率随时间的变化趋势并画图表示。

③该反应在温度T1下的平衡常数K= 。
(保留两位有效数字)
(3)HCOOH成为质子膜燃料电池的燃料有很好的发展前景。
写出该燃料电池的电极反应式:
。
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省高三5月综合测试理综化学试卷(解析版) 题型:选择题
下列图示与对应的叙述相符的是

A.图1表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图2表示0.1000mol?L—1 NaOH溶液滴定20.00mL 0.1000mol?L—1 CH3COOH溶液的滴定曲线
C.图3表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液
D.图4表示某可逆反应生成物的量随反应时间的变化,t时V正<V逆
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省佛山市高三教学质量检测二理综化学试卷(解析版) 题型:选择题
下列有关物质的性质和该性质的应用均正确的是
A.SiO2具有较好的导电性,可用于制造半导体材料
B.H2O2是一种绿色氧化剂,可氧化酸性高锰酸钾而产生O2
C.铜的金属活动性比铁弱,可用铜罐代替铁罐贮运浓硝酸
D.Mg在空气中燃烧发出耀眼的白光,可用于制作信号弹
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省高二下学期期中化学试卷(解析版) 题型:推断题
(12分) 格氏试剂(RMgX)是有机反应中的一种重要试剂,它的制法为:
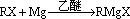 (R为烃基,X为卤素)格氏试剂能与醛反应生成醇,反应历程为:
(R为烃基,X为卤素)格氏试剂能与醛反应生成醇,反应历程为:
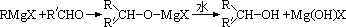
(R,R′可以是相同的烃基,也可能是不同的烃基)现用乙烯和适当的无机物合成乙酸异
丁酯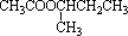 的过程如下(反应条件没有列出):
的过程如下(反应条件没有列出):
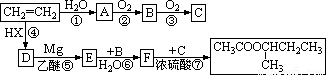
试回答:(1)上述过程中,属于加成反应的是_______(填反应序号),并写出下列指定
物质的结构简式C__________、E_________、F_________。
(2)反应②的化学方程式___________________________________。
(3)反应⑦的化学方程式___________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省高二下学期期中化学试卷(解析版) 题型:选择题
1 mol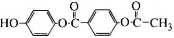 与足量的NaOH溶液充分反应,消耗的NaOH
与足量的NaOH溶液充分反应,消耗的NaOH
的物质的量为
A.5 mol B.4 mol C.3 mol D.2 mol
查看答案和解析>>
科目:高中化学 来源:2013-2014广东清远市市高一下学期期末考试化学试卷(解析版) 题型:选择题
下列有关环境保护与绿色化学的叙述不正确的是
A.形成酸雨的主要物质是硫的氧化物和氮的氧化物
B.大气污染物主要来自化石燃料燃烧和工业生产过程产生的废气
C.绿色化学的核心就是如何对被污染的环境进行无毒无害的治理
D.水华、赤潮等水体污染主要是由含氮、磷的生活污水任意排放造成的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com