
| A、原子半径:Na>Mg>O |
| B、还原性:F->Cl->S2- |
| C、酸性:H3PO4>H2SO4>HClO4 |
| D、稳定性:H2O>HF>H2S |


科目:高中化学 来源: 题型:
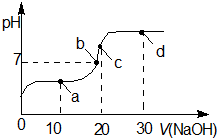 室温时,向20mL 0.1mol?L-1的醋酸溶液中不断滴入0.1mol?L-1的NaOH溶液,溶液的pH变化曲线,如图所示.在滴定过程中,关于溶液中离子浓度大小关系的描述不正确的是( )
室温时,向20mL 0.1mol?L-1的醋酸溶液中不断滴入0.1mol?L-1的NaOH溶液,溶液的pH变化曲线,如图所示.在滴定过程中,关于溶液中离子浓度大小关系的描述不正确的是( )| A、a点时:c ( CH3COOH )>c ( Na+)>c ( CH3COO-)>c ( H+)>c ( OH -) |
| B、b点时:c ( Na+)=c ( CH3COO-)>c ( H+)=c ( OH-) |
| C、c点时:c ( OH-)=c ( CH3COOH )+c ( H+) |
| D、d点时:c ( Na+)>c ( CH3COO-)>c (OH-)>c ( H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
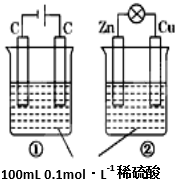
| 选择 | 叙述 | 评价 |
| A | 装置名称:①是电解池,②是原电池 | 错误 |
| B | 硫酸浓度变化:①增大,②减小 | 正确 |
| C | 电极反应式:①中阳极:4OH--4e-═2H2O+O2↑ ②中正极:Zn-2e-═Zn2+ | 正确 |
| D | 离子移动方向:①中H+向阴极方向移动 ②中H+向正极方向移动 | 错误 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
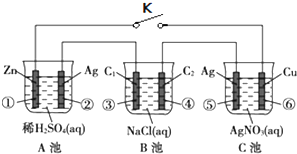
| A、K闭合前,水的电离程度A池>B池>C池 |
| B、K闭合后,A池、C池为原电池,B池为电解池 |
| C、K闭合后,①⑤电极质量减小,⑥电极质量增大,②③④电极上有气泡冒出 |
| D、K闭合一段时间后,A池pH增大,B池、C池pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
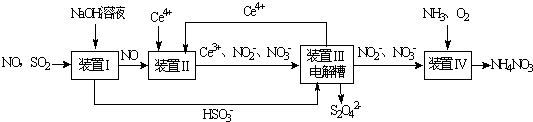
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学方程式 | K(t1) | K(t2) |
| F2+H2?2HF | 1.8×1036 | 1.9×1032 |
| Cl2+H2?2HCl | 9.7×1012 | 4.2×1011 |
| Br2+H2?2HBr | 5.6×107 | 9.3×106 |
| I2+H2?2HI | 43 | 34 |
| A、已知t2>t1,HX的生成反应为放热反应 |
| B、在相同条件下,X2平衡转化率:F2>Cl2 |
| C、X2与H2反应的剧烈程度随着原子序数递增逐渐减弱 |
| D、HX的稳定性:HBr>HI |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2+H2O═H2CO3化合反应 | ||||
| B、Cu(OH)2═CuO+H2O 分解反应 | ||||
C、Fe2O3+3CO
| ||||
| D、NaCl+AgNO3═AgCl↓+NaNO3复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、宁波从2012年3月25日起公布了空气中的PM2.5,PM2.5是指空气中细颗粒物直径≤2.5pm的颗粒物 |
| B、“可燃冰”的燃烧、从海水中提取镁、铜的电解精炼、石油分馏全都是化学变化的过程 |
| C、蛋白质的二级结构主要依靠肽链中-NH-上的氢原子与羰基上的氧原子形成氢键而实现的 |
D、原子结构模型的演变历史可表示为: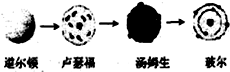 PM2.5是指空气中细颗粒物直径≤2.5 p m的颗粒物 PM2.5是指空气中细颗粒物直径≤2.5 p m的颗粒物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com