
【题目】Ⅰ.已知铜在常温下能被HNO3溶解。反应方程式为: 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(1)请将上述反应改成离子方程式,并用单线桥法表示电子得失的方向和数目_______。
(2)若生成0.2mol的NO,则该过程中转移的电子是___________mol。
(3)被还原的硝酸占参加反应硝酸的比例为___________。
Ⅱ.某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2;已知该反应中H2O2只发生如下过程:H2O2→ O2,写出该化学方程式_________。
【答案】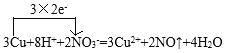 0.6 1:4 2H2CrO4+3H2O2=2Cr(OH)3↓+3O2↑+2H2O
0.6 1:4 2H2CrO4+3H2O2=2Cr(OH)3↓+3O2↑+2H2O
【解析】
(1)根据离子方程式书写方法将反应改写为离子方程式,结合化合价升高元素失电子,化合价降低元素得到电子,化合价升高数=化合价降低数=转移电子数,用单线桥法表示电子转移;
(2)先根据方程式判断转移电子数目与产生NO气体的物质的量关系,然后计算;
(3)分析方程式中N元素化合价降低的占N原子总物质的量的百分比可得解;
II.该反应中H2CrO4→Cr(OH)3,Cr元素的化合价降低,则反应中H2CrO4为氧化剂,被还原为Cr(OH)3,所以H2O2发生如下过程:H2O2→O2,O元素化合价升高,H2O2被氧化,作还原剂,根据氧化还原反应中元素化合价升降总数相等配平方程式。
I.(1) 在反应3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O中HNO3、Cu(NO3)2溶于水且发生电离,写成离子形式,Cu、NO、H2O仍然用化学式表示,则该反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。在该反应中,Cu元素化合价升高失电子,N元素化合价降低得到电子,化合价升高数=化合价降低数=转移电子数=6,实验用单线桥法表示电子转移情况如下: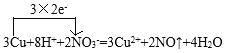 ;
;
(2)根据方程式可知:每转移6mol电子,会产生2molNO气体,则生成0.2mol的NO,则该过程中转移的电子的物质的量是0.6mol;
(3)根据方程式可知:8molHNO3参加反应,其中2molN原子化合价降低,获得电子,作氧化剂,6molN原子化合价没有变化,起酸的作用,故被还原的硝酸占参加反应硝酸的比例为2:8=1:4。
II.该反应中H2CrO4→Cr(OH)3,Cr元素的化合价降低,则反应中H2CrO4为氧化剂,被还原为Cr(OH)3,所以H2O2只发生如下过程:H2O2→O2,O元素化合价升高,H2O2被氧化,作还原剂,根据氧化还原反应中元素化合价升降总数相等可知,反应的方程式为:2H2CrO4+3H2O2=2Cr(OH)3+3O2↑+2H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中仅含有H+、NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种(忽略水的电离和离子的水解),取该溶液进行连续实验,实验过程如下:

下列有关推断合理的是
A. 根据上述连续实验不能确定溶液X中是否含有Fe3+
B. 沉淀H为Al(OH)3、BaCO3的混合物
C. 溶液中一定含有H+、Al3+、NH4+、Fe2+、SO42-、Cl-
D. 若溶液X为100 mL,产生的气体A为112 mL(标况),则X中c(Fe2+)=0.05mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将两种金属单质组成的混合物11g,加到足量稀硫酸中,最终得到11.2L(标准状况下)的氢气,这两种金属可能是( )
A.Zn和FeB.Ag和MgC.Al和 CuD.Mg和Zn
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从含碘废液(除H2O外,含有CCl4、I2、I等)中回收碘,其实验过程如下:
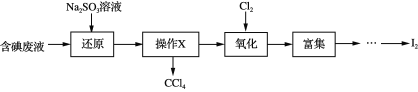
下列叙述不正确的是
A.“还原”步骤发生的反应为:SO32+I2+H2O == 2I+SO42+2H+
B.“操作X”为静置、分液,所得CCl4可用作“富集”的萃取剂
C.“氧化”过程中,为使I完全被氧化,需长时间通入Cl2
D.“富集”即I2富集于有机溶剂,同时除去某些杂质离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成某药物的中间体G的流程如图:

请回答下列问题:
(1)A的名称为___(系统命名法),F的分子式为___。反应⑤的反应类型是___。
(2)C中含氧官能团的名称为__。
(3)已知一定条件下2分子乙酸分子间脱水生成1分子乙酸酐,写出该反应的化学方程式:___。
(4)写出满足下列条件的E的同分异构体的结构简式:___。
①苯环上只有三个取代基;
②核磁共振氢谱图中只有4组吸收峰;
③1mol该物质与足量NaHCO3溶液反应生成2molCO2。
(5)根据已有知识并结合相关信息,写出以C6H5—OOCCH2CH3为原料制备 的合成路线流程图(无机试剂任选)。___。
的合成路线流程图(无机试剂任选)。___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.苯与苯乙烯具有相同最简式但不是同系物
B.乙醚和乙醇互为同分异构体
C.CH3—C≡C—CH=CH—![]() —CH3分子中最多可以有20个原子共平面
—CH3分子中最多可以有20个原子共平面
D.CH3CH2CH2CH3 和C(CH3)4互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等物质的量的N2、O2、CO2混合气体通过Na2O2后,体积变为原体积的8/9(同温同压),这时混合气体中N2、O2、CO2物质的量之比为
A. 6︰9︰0 B. 3︰3︰2 C. 6︰7︰3 D. 3︰4︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气因热值高、来源广、产物无污染,常被人们看做一种理想的“绿色能源”,氢气的制取是氢能源利用领域的研究热点。
(1)H2O的热分解可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如图1所示。图1中曲线A对应的物质是______________。
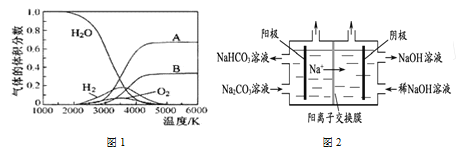
(2)图2为用电解法制备H2,写出阳极的电极反应式:________________。
(3)从可持续发展考虑,太阳能光解水制氢是获取H2的最好途径,但迄今仍然存在诸多问题,如光催化剂大多仅在紫外光区稳定有效,能够在可见光区使用的光催化剂不但催化活性低,而且几乎都存在光腐蚀现象,需使用牺牲剂进行抑制,能量转化效率低等,这些都阻碍了光解水的实际应用,需设计课题进一步研究解决。下列设想符合研究方向的是_________
A 将研究方向专注于紫外光区,无需考虑可见光区
B 研究光腐蚀机理,寻找高稳定性,不产生光腐蚀的制氢材料
C 研制具有特殊结构的新型光催化剂,开发低成本、高性能光催化材料
D 研究新的光解水的催化机制,使利用红外光进行光解水制氢成为可能
(4)以甲烷为原料制取氢气是工业上常用的制氢方法。
已知:CH4(g) + H2O(g) = CO(g)+ 3H2 (g) ΔH= -206.2 kJmol-1
CH4(g) + CO2 (g) = 2CO(g)+ 2H2 (g) ΔH= -247.4 kJmol-1
则CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为:_________
(5)利用废弃的H2S的热分解可生产H2:2H2S(g) ![]() 2H2(g)+S2(g)。现将0.30 mol H2S(g)通入到压强为p的恒压密闭容器中,在不同温度下测得H2S的平衡转化率如图3所示:
2H2(g)+S2(g)。现将0.30 mol H2S(g)通入到压强为p的恒压密闭容器中,在不同温度下测得H2S的平衡转化率如图3所示:
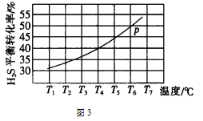
①温度为T4℃时,初始体积为1L,t分钟后,反应达到平衡,该温度下的平衡常数K=________。
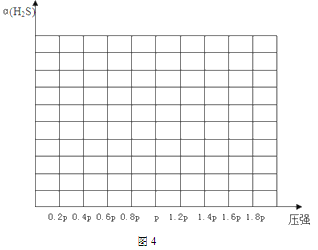
②若保持恒温T℃,将一定量的 H2S(g)通入到恒压密闭容器中,反应一段时间后,压强为p的体系恰好达到平衡,试在图4上画出不同起始压强下H2S转化率的趋势图________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。回答下列问题:
(1)NaClO2的化学名称为_______。
(2)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×103mol·L1。反应一段时间后溶液中离子浓度的分析结果如下表。
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式__________。增加压强,NO的转化率______(填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐______ (填“增大”“不变”或“减小”)。
③由实验结果可知,脱硫反应速率______脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________。
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压pe如图所示。
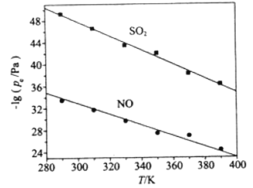
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均______________(填“增大”、“不变”或“减小”)。
②反应ClO2+2SO32 2SO42+Cl的平衡常数K表达式为___________。
(4)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com