
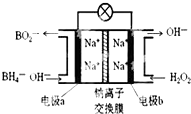
 某新型电池NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )
某新型电池NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )| A. | 电池工作时Na+从b极区移向a极区 | |
| B. | a极上的电极反应式为:BH4-+8OH--8e-=BO2-+6H2O | |
| C. | b极上的电极反应式为:H2O2+2e-+2H+=2H2O | |
| D. | 每消耗3molH2O2,转移3mole- |
分析 由原电池工作原理示意图可知反应中BH4-被氧化为BO2-,应为原电池的负极反应,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,正极H2O2得电子被还原生成OH-,电极反应式为H2O2+2e-=2OH-,原电池工作时,阳离子向正极移动,阴离子向负极移动,以此解答该题.
解答 解:由原电池工作原理示意图可知反应中BH4-被氧化为BO2-,应为原电池的负极反应,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,正极H2O2得电子被还原生成OH-,
A.该装置是原电池,原电池放电时,阳离子向正极移动,所以Na+从a极区移向b极区,故A错误;
B.反应中BH4-被氧化为BO2-,应为原电池的负极反应,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,故B正确;
C.b电极反应式应该为H2O2+2e-=2OH-,故C错误;
D.根据b电极反应式H2O2+2e-=2OH-可判断每消耗3molH2O2,转移的电子为6mol,故D错误;
故选:B.
点评 本题考查原电池的工作原理,题目难度中等,本题注意根据物质化合价的变化判断两极反应为解答该题的关键,注意电极反应式的书写.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 该溶液中K+、Mg2+、H+、NO3-不能大量共存 | |
| B. | 溶液中的NH4+与Fe3+均发生水解反应,且相互促进 | |
| C. | 加入金属铜与Fe3+反应的离子方程式为:2Fe3++3Cu=2Fe+3Cu2+ | |
| D. | 向其中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:NH4++Fe3++2SO42-+2Ba2++4OH-=2BaSO4↓+NH3•H2O+Fe(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图甲表示反应:4CO(g)+2NO2(g)?N2(g)+4CO2(g)△H<0,在其他条件不变的情况下,改变起始物CO的物质的量对此反应平衡的影响,则有T1>T2,K1>K2 | |
| B. | 图乙表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(g)的影响,乙的压强比甲的压强大 | |
| C. | 图丙表示的反应是吸热反应,该图表明催化剂能改变化学反应的焓变 | |
| D. | 图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)?N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,属于分子晶体(填晶体类型).
,属于分子晶体(填晶体类型).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 I、离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7-和AlCl4-组成的离子液体作电解液时,可在钢制品上电镀铝.
I、离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7-和AlCl4-组成的离子液体作电解液时,可在钢制品上电镀铝.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 如果某化合物只含共价键,则其一定是共价化合物 | |
| B. | 焓变小于0而熵变大于0的反应肯定是自发反应 | |
| C. | 对于给定条件下反应物之间同时发生多个反应的情况,理想的催化剂可以大幅度提高目标产物在最终产物中的比率 | |
| D. | 绿色化学的核心是利用化学原理对产生的环境污染进行治理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使甲基橙变红色的溶液中:K+、Na+、SO42-、CO32- | |
| B. | pH=14的溶液中:K+、Na+、Cl-、AlO2- | |
| C. | 0.1 mol•L-1NH4I溶液中:Na+、Fe3+、Cl-、SO42- | |
| D. | 与铝反应产生大量氢气的溶液中:Na+、NH4+、HCO3-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com