
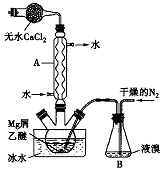
 无水MgBr2可用作催化剂.实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图所示(夹持仪器略去).主要步骤如下:
无水MgBr2可用作催化剂.实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图所示(夹持仪器略去).主要步骤如下:分析 (1)根据仪器构造和作用可知;
(2)将所用液溴一次性全部加入三颈瓶中,反应过于剧烈,使反应过程难以控制,故在步骤2中,通入干燥的氮气,形成的气流促进液溴挥发到三颈瓶反应;
(3)反应完毕后恢复至常温,过滤除去固体为镁屑;冷却至0℃,析出晶体,过滤得三乙醚合溴化镁粗品,说明三乙醚合溴化镁在0℃时的溶解度较小,常温下用苯溶解粗品,说明可溶于苯等有机溶剂;
(4)根据同一还原剂与不同氧化剂反应,与氧化性强的氧化剂反应更剧烈设计;
(5)根据Mg~MgBr2,可计算理论上的产品质量,再计算产率即可.
解答 解:(1)仪器A为球形冷凝管,作用是使挥发出的乙醚和溴蒸气冷却并回流至反应装置;
故答案为:球形冷凝管;使挥发出的乙醚和溴蒸气冷却并回流至反应装置;
(2)将所用液溴一次性全部加入三颈瓶中,反应过于剧烈,使反应过程难以控制,故在步骤2中,通入干燥的氮气,形成的气流促进液溴挥发到三颈瓶反应;
故答案为:氮气的气流促进了液溴的挥发;反应过于剧烈,使反应过程难以控制;
(3)反应完毕后恢复至常温,过滤除去固体为镁屑;冷却至0℃,析出晶体,过滤得三乙醚合溴化镁粗品,说明三乙醚合溴化镁在0℃时的溶解度较小,常温下用苯溶解粗品,说明可溶于苯等有机溶剂;
故答案为:镁屑;可溶于苯等有机溶剂,在0℃时的溶解度较小;
(4)同一还原剂与不同氧化剂反应,与氧化性强的氧化剂反应更剧烈,根据Mg的性质证明O2的氧化性比N2的强可将燃着的镁带分别插入O2和N2中,前者燃烧剧烈;
故答案为:将燃着的镁带分别插入O2和N2中,前者燃烧剧烈;
(5)根据Mg~MgBr2,则理论上生成的m(MgBr2)=$\frac{10g×184}{24}$=76.7g,则该实验制取MgBr2的产率为$\frac{61.4}{76.7}×100%$=80.1%
故答案为:80.1%.
点评 本题考查了物质制备实验方案的设计、物质分离提纯的综合应用,为高频考点,侧重考查学生的分析能力和实验能力,注意把握实验的原理和操作方法,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸与氢氧化钾溶液反应:H++OH-═H2O | |
| B. | 过氧化钠与水反应:2Na2O 2+2H2O═4Na++4OH-+O2↑ | |
| C. | 氧化铁溶于盐酸:Fe2O3+6H+═2Fe3++3H2O | |
| D. | Na与硫酸铜溶液反应:2Na+Cu2+═2Na++Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 皂化反应的产物是高级脂肪酸和甘油 | |
| B. | 酯化反应和酯的水解反应均为取代反应 | |
| C. | 将苯与浓溴水混合可制取溴苯 | |
| D. | 新戊烷和2-甲基丁烷是同一种物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 的名称是2,4-二甲基戊烷,对二甲苯的结构简式是
的名称是2,4-二甲基戊烷,对二甲苯的结构简式是
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 阳离子 | Al3+、Ba2+ |
| 阴离子 | OHˉ、SO42ˉ、Clˉ |
| A. | 往甲和乙的混合溶液中加入过量的丁溶液一定会生成白色沉淀 | |
| B. | 丙和丁的水溶液混合后会生成白色沉淀 | |
| C. | 一定温度下,丙溶于水会使水的电离程度增大 | |
| D. | 一定温度下,甲溶于水会使水的电离程度减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将混有HCl的Cl2通入饱和NaHCO3溶液中除去HCl | |
| B. | 用澄清石灰水鉴别NaHCO3和Na2CO3 | |
| C. | 用BaCl2溶液鉴别SO42-和SO32- | |
| D. | 用浓HNO3与Cu反应制备NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铝及其化合物在生产和生活等方面有广泛的应用.请回答下列问题:
铝及其化合物在生产和生活等方面有广泛的应用.请回答下列问题: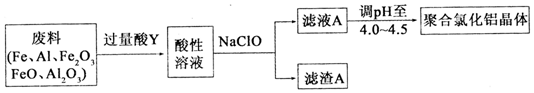
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
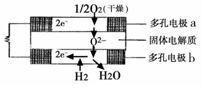 固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的.它以固体氧化锆一氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( )
固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的.它以固体氧化锆一氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( )| A. | 该电池的总反应方程式为:2H2+O2=2H2O | |
| B. | 电子由a极流向b极 | |
| C. | a极对应的电极反应式为2H2O+O2-4e=4OH- | |
| D. | 有O2参加反应的a极为电池的阳极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 我国首艘航母“辽宁舰”上用于载机降落的拦阻索是特种钢缆,属于金属材料 | |
| B. | 研制高性能的耐磨轮胎,可减少PM2.5等颗粒物的产生 | |
| C. | 采用纳米TiO2光触媒技术,将装修材料中释放的HCHO转化为无害物质 | |
| D. | 高纯度的硅单质广泛用于光导纤维,光导纤维遇强碱会造成“短路” |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com