

分析 (1)Na2CO3、NaHCO3固体,各滴加几滴水,是碳酸钠与水反应生成结晶水合物,是放热反应,而碳酸氢钠是溶解于水是吸热的过程;
(2)①碳酸钠与盐酸反应首先碳酸钠转化为碳酸氢钠,然后碳酸氢钠与盐酸反应生成氯化钠;
②由①知B点的主要溶质是NaCl和NaHCO3;
③B点溶液溶解了少量二氧化碳,使溶液呈酸性,同时B点碳酸氢钠的浓度小于D点碳酸氢钠的浓度,所以B点的PH小于D点的PH;
(3)NaHCO3有酸性,所以碳酸氢根离子电离产生氢离子和碳酸根离子,氢离子与镁反应生成氢气和镁离子,由此分析解答.
解答 解:(1)Na2CO3、NaHCO3固体,各滴加几滴水,是碳酸钠与水反应生成结晶水合物,是放热反应,而碳酸氢钠是溶解于水是吸热的过程,故答案为:碳酸钠与水反应生成Na2CO3•xH2O,属于放热反应;NaHCO3只有溶解扩散现象,吸收热量;
(2)①碳酸钠与盐酸反应首先碳酸钠转化为碳酸氢钠,所以第一次溶液呈碱性,达到两次反应终点是B,然后碳酸氢钠与盐酸反应生成氯化钠,呈中性,达到两次反应终点是C,故选:BC;
②由①知B点的主要溶质是NaCl和NaHCO3,故答案为:NaCl和NaHCO3;
③B点溶液溶解了少量二氧化碳,使溶液呈酸性,同时B点碳酸氢钠的浓度小于D点碳酸氢钠的浓度,所以B点的PH小于D点的PH,故答案为:小于;B点溶液溶解了少量二氧化碳,同时NaHCO3的浓度低于D点;(3)NaHCO3有酸性,所以碳酸氢根离子电离产生氢离子和碳酸根离子,氢离子与镁反应生成氢气和镁离子,所以反应方程式为:2NaHCO3+Mg=MgCO3↓+Na2CO3+H2↑,故答案为:2NaHCO3+Mg=MgCO3↓+Na2CO3+H2↑.
点评 本题主要考查碳酸钠和碳酸氢钠与酸反应的知识,难度中等,注酸钠酸的性质的灵活用,碳酸钠与酸反应首先生成碳酸氢钠,然后碳酸氢钠与盐酸反应生成氯化钠.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
| 温度/℃ | 25 | 200 | 300 | 400 | 500 |
| K | 5×108 | 1.0 | 0.86 | 0.507 | 0.152 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,20gH218O中含有中子数目为12NA | |
| B. | 标准状况下,11.2LC2H6中含有极性键的数目为3.5NA | |
| C. | 1LpH=3的CH3COOH溶液中,含有H+的数目大于10-3NA | |
| D. | 1L1mol•L-1稀硝酸(还原产物为NO)与铁完全反应,转移电子数目为0.75NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28gMgCO3和NaHCO3混合固体中的CO32-离子数为NA | |
| B. | lmolI2与4molH2反应生成的HI分子数为2NA | |
| C. | 1molAl溶于含1molNaOH溶液,电子转移数为3NA | |
| D. | 标准状况下,2.24LH2O含有的共价键数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠投入CuSO4溶液中:2Na+Cu2+═2Na++Cu | |
| B. | 过量的CO2通入Ca(ClO)2溶液中:ClO-+CO2+H2O═HCO3-+HClO | |
| C. | 向Mg(OH)2悬浊液中滴加四滴0.1mol•L-1FeCl3溶液:3Mg(OH)2(S)+2Fe3+(aq)═2Fe(OH)3(S)+3Mg2+(aq) | |
| D. | 铅酸蓄电池充电时的阳极反应:PbSO4+2H2O-2e-═PbO2+4H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76.8 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
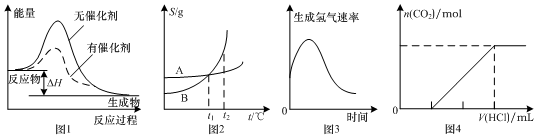
| A. | 图1表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| B. | 图2表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A | |
| C. | 图3表示镁条放入盐酸中生成氢气速率随时间的变化,起初反应速率加快的原因可能是该反应为放热反应 | |
| D. | 图4表示在含等物质的量NaOH、Na2CO3的混合溶液中滴加0.1 mol•L-1盐酸至过量时,产生气体的体积与消耗盐酸的关系 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com