
| 40 |
| 7-2 |
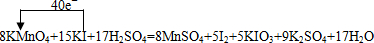 ,
,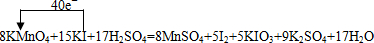 .
.

科目:高中化学 来源: 题型:
| A、c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH) |
| B、c(CH3COO-)+c(CH3COOH)=0.01 mol/L |
| C、c(CH3COO-)+c(OH-)-c(H+)=0.008 mol/L |
| D、c(H+)=0.002 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分离FeCl3和AlCl3两种物质的混合物,只用氢氧化钠和二氧化碳即可 |
| B、用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出 |
| C、稀硫酸滴定未知浓度的NaHCO3溶液,用甲基橙作指示剂,溶液由黄色变为橙色 |
| D、在50mL量筒中配制0.1000mol?L-1碳酸钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
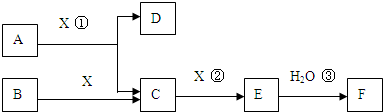
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
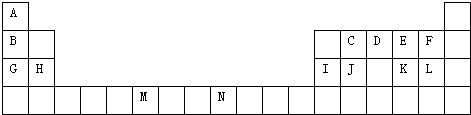
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com