
| 物质 | CO | H2 | CH3OH |
| 浓度(mol?L-1) | 0.9 | 1.0 | 0.6 |
| 0.6 |
| 0.9×(1.0)2 |
| 2 |
| 3 |
| 2 |
| 3 |
| 1 |
| 1.5×(1.0)2 |


科目:高中化学 来源: 题型:
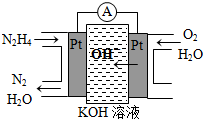
 肼(N2H4)又称联氨,是一种可燃性液体,与氧气或氮氧化物反应均可生成氮气和水,用作火箭燃料.
肼(N2H4)又称联氨,是一种可燃性液体,与氧气或氮氧化物反应均可生成氮气和水,用作火箭燃料.查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (2011?丹东模拟)肼(N2H4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料.
(2011?丹东模拟)肼(N2H4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料. N2H+5+OH-;N2H+5+H2O
N2H+5+OH-;N2H+5+H2O N2H+6+OH-
N2H+6+OH- N2H+5+OH-;N2H+5+H2O
N2H+5+OH-;N2H+5+H2O N2H+6+OH-
N2H+6+OH-查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 肼(N2H4)又称联氨,是一种可燃性液体,用作火箭燃料.
肼(N2H4)又称联氨,是一种可燃性液体,用作火箭燃料.查看答案和解析>>
科目:高中化学 来源: 题型:
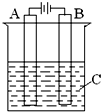
 肼(N2H4)又称联氨,可用作火箭燃料.肼一空气燃料电池中的电解质溶液是20%~30%的KOH溶液.该燃料电池可作为如图装置中的电源.下列判断错误的是( )
肼(N2H4)又称联氨,可用作火箭燃料.肼一空气燃料电池中的电解质溶液是20%~30%的KOH溶液.该燃料电池可作为如图装置中的电源.下列判断错误的是( )查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com