
铁及其化合物在工业上有许多用途。回答下列有关问题:
(1) FeCl3可用于金属蚀刻、污水处理等。工业生产中FeCl3可由NaClO3氧化酸性FeCl2废液(含有的溶质为FeCl2、FeCl3、HCl)制备。
①写出NaClO3氧化酸性FeCl2废液的离子方程式:_______________。
②测得pH=2的FeCl2废液中,c(Cl-)=5.3×10-2mol· L-1,c(Fe3+)=1.0×10-3mol· L-1,则c(Fe2+)=____mol· L-1,若在FeCl3的某次生产中处理了1m3该FeCl2废液,则反应中转移的电子为_________mol。
(2)铁系氧化物材料在五金器材的抛光、光学仪器和玉石的磨光材料、吸波材料、半导体材料等方面得以广泛应用。在空气中加热FeCO3可制得铁系氧化物材料。已知:
①4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1648kJ·mol-1;
②C(s)+O2(g)= CO2(g) ΔH=-393kJ·mol-1;
③2Fe(s)+2C(s) +3O2(g) =2FeCO3(s) ΔH=-1480kJ·mol-1;
则在空气中加热FeCO3生成铁系氧化物Fe2O3的热化学方程式为_____________。
(3)已知在某种含铁催化剂作用下发生下列反应;CO(g)+3H2(g)  CH4(g)+ H2O (g) ΔH<0。
CH4(g)+ H2O (g) ΔH<0。
一定温度下和压强条件下,把1molCO和3molH2加入到压强为P0的恒压密闭容器中,测得不同时间CO的体积分数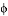 (CO)如下表:
(CO)如下表:
t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| 0.250 | 0.230 | 0.214 | 0.202 | 0.200 | 0.200 |
①当______不再发生变化时(写出一条即可),则表明CO(g)+3H2(g)  CH4(g)+ H2O (g)达到平衡。
CH4(g)+ H2O (g)达到平衡。
②达到平衡时CO的转化率为________;若用平衡分压代替平衡浓度,则该温度下的平衡常数K=____(已知:气体分压=气体总压×体积分数)。
③若下图中表示该反应中CO的平衡转化率与温度、压强的关系。图中温度T1、T2、T3由高到低的顺序是______________。
科目:高中化学 来源:2017届吉林省长春市高三下学期第二次质量监测理综化学试卷(解析版) 题型:选择题
W、X、Y、Z均为短周期元素,原子序数依次增大,W的原子核外最外层电子数是次外层电子数的2倍,X-与Y+具有相同的电子层结构,Z的阴离子不能发生水解反应。下列说法不正确的是( )
A. 原子半径: Y>Z>X>W
B. 简单氢化物的稳定性:W<Z<X
C. Z与W、Y形成的化合物中,其化学键类型不相同
D. 最高价氧化物的水化物的酸性:W<Z
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二3月学业水平测试化学试卷(解析版) 题型:选择题
下列关于乙醇、乙酸的说法正确的是( )
A. 都含有羧基 B. 都能与金属钠反应生成氢气
C. 乙醇溶液显碱性,乙酸溶液显酸性 D. 都能使紫色石蕊溶液变红色
查看答案和解析>>
科目:高中化学 来源:2017届四川省乐山市高三第二次调查研究考试理科综合化学试卷(解析版) 题型:简答题
碳酸亚铁(FeCO3)是菱镁矿的主要成分,将FeCO3加热到200℃开始分解为FeO和CO2,若在空气中高温煅烧FeCO3生成Fe2O3。
I.已知25℃,101kPa时:4Fe(s)+3O2(g)=2Fe2O3(s) △H=-1648kJ/mol
C(s)+ O2(g)=CO2(g) △H=-393 kJ/mol 2FeCO3(s)=2Fe(s)+ 3O2(g) △H=+148OkJ/mol
(1)请写出FeCO3在空气中煅烧生成Fe2O3的热化学方程式_______。
Ⅱ.生成的FeO和Fe2O3在一定条件下被还原为金属铁。
(2)据报道一定条件下Fe2O3可被甲烷还原为“纳米级”的金属铁。其反应为:
Fe2O3(s)+3CH4(g)=2Fe(s)+3CO(g)+6H2(g) △H>0
① 原子序数为26的铁元素位于元素周期表的第_______周期。
②反应在5L的密闭容器中进行,2min后达到平衡,测得Fe2O3在反应中质量消耗4.8g。则该段时间内用H2表达的平均反应速率为____________。
③将一定量的Fe2O3(s)和一定量的CH4(g)置于恒温恒压容器中,在一定条件下反应,能表明该反应达到平衡状态的是___________。
a.CH4的转化率等于CO的产率 b.混合气体的平均相对分子质量不变
c.v正(CO):v逆(H2)=1:2 d.固体的总质量不变
(3)FeO可用CO进行还原,已知:t℃时,FeO(s)+CO(g) Fe(s)+CO2(g),K=0.5,若在1L密闭容器中加入0.04mol FeO(s),并通入xmolCO,t℃时反应达到平衡。此时FeO(s)的转化率为50%,则x=_______。
Fe(s)+CO2(g),K=0.5,若在1L密闭容器中加入0.04mol FeO(s),并通入xmolCO,t℃时反应达到平衡。此时FeO(s)的转化率为50%,则x=_______。
Ⅲ. Fe2O3还可用来制备FeCl3,FeCl3在水溶液中的水解分三步:
Fe3++H2O Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++ H2O Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)2++ H2O Fe (OH)3+H+ K3
Fe (OH)3+H+ K3
(4)以上水解反应的平衡常效K1、K2、K3由大到小的顺序是_______。通过控制条件,以上水解产物聚合生成聚合物的离子方程式为:xFe3++yH2O===Fex(OH)y(3x-y)++yH+
欲使平衡正向移动可采用的方法是__________(填字母)
a.加水稀释 b.加入少量NaCl固体 c.升温 d.加入少量Na2CO3固体
查看答案和解析>>
科目:高中化学 来源:2017届四川省乐山市高三第二次调查研究考试理科综合化学试卷(解析版) 题型:选择题
下列各组离子在指定条件下可能大量共存的是
A. 不能使酚酞试液变红的无色溶液中:Na+、CO32-、K+、ClO-
B. 能与金属铝反应放出氢气的溶液中:K+、NO3-、Cl-、NH4+
C. 常温下水电离出的c(H+)水·c(OH-)水=10-10的溶液中:Na+、Cl-、S2-、SO32-
D. 无色透明溶液:K+、HCO3-、K+、SO42-、Fe3+
查看答案和解析>>
科目:高中化学 来源:2017届河南省安阳市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
下列实验对应的现象及结论均正确,且两者具有因果关系的是
选项 | 实验 | 现象 | 结论 |
A | 向稀硝酸与过量铜粉反应后的溶液中滴加稀硫酸 | 有气泡生成 | 常温下,铜与稀硫酸反应生成SO2 |
B | 在酒精灯上加热铝箔 | 铝熔化,但熔化的铝不滴落 | Al2O3的熔点比Al高 |
C | 向Fe(SCN)3溶液中滴加稀NaOH溶液 | 溶液有红色变为红褐色 | 减小反应物浓度、平衡向逆反应方向移动 |
D | 选用酚酞作试剂,用NaOH溶液滴定醋酸溶液 | 溶液变为粉红色 | NaOH溶液过量 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三上学期第四次月考理科综合化学试卷(解析版) 题型:简答题
雾霾天气是一种大气污染状态,雾霾的源头多种多样,比如汽车尾气、工业排放、建筑扬尘、垃圾焚烧,甚至火山喷发等。
(1)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂的条件下可净化。
①已知部分化学键的键能如下
分子式/结构式 | NO/N≡O | CO/C≡O | CO2/O=C=O | N2/N≡N |
化学键 | N≡O | C≡O | C=O | N≡N |
键能(KJ/mol) | 632 | 1072 | 750 | 946 |
请完成汽车尾气净化中NO(g)和CO(g)发生反应的热化学方程式
2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH=_________kJ/mol
N2(g)+2CO2(g) ΔH=_________kJ/mol
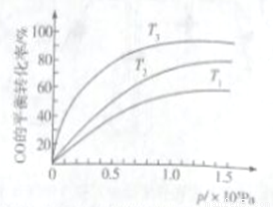
②若上述反应在恒温、恒容的密闭体系中进行,并在t1时刻达到平衡状态,则下列示意图不符合题意的是_________(填选项序号)。(下图中v正、K、n、P总分别表示正反应速率、平衡常数、物质的量和总压强)
 (2)在t1℃下,向体积为10L的恒容密闭容器中通入NO和CO , 测得了不同时间时NO和CO的物质的量如下表:
(2)在t1℃下,向体积为10L的恒容密闭容器中通入NO和CO , 测得了不同时间时NO和CO的物质的量如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/×l0-2mol | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
n(CO)/×l0-1mol | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
t1℃时该反应的平衡常数K=__,既能增大反应速率又能使平衡正向移动的措施是_。(写出一种即可)
(3)如图1所示,以N2O4为原料采用电解法可制备新型绿色硝化剂(一种氮氧化物)写出生成这种硝化剂的阳极电极反应式________________________。
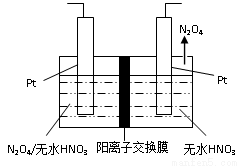
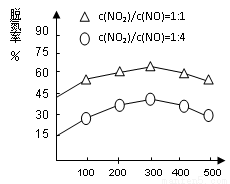
图1 图2
(4)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。在氨气足量的情况下,不同c(NO2)/c(NO)、不同温度对脱氮率的影响如图2所示(已知氨气催化还原氮氧化物的正反应为放热反应),请回答温度对脱氮率的影响____________________,给出合理的解释:____________________________________。
查看答案和解析>>
科目:高中化学 来源:2017届湖北省黄冈市高三3月质量检测理科综合化学试卷(解析版) 题型:选择题
薄荷醇的结构简式如下图,下列说法正确的是
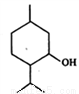
A. 薄荷醇属于芳香烃的含氧衍生物
B. 薄荷醇分子式为C10H20O,它是环己醇的同系物
C. 薄荷醇环上的一氯取代物只有三种
D. 在一定条件下,薄荷醇能与氢气、溴水反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省邯郸市高二上学期期末考试化学试卷(解析版) 题型:简答题
向一容积为5L的恒容密闭容器内,充入0.2molCO和0.4molH2O,在一定条件下发生反应:CO(g)+H2O(g)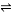 CO2(g)+H2(g) ΔH>0。反应中CO2的浓度(c)随时间(t)的变化关系如图所示。
CO2(g)+H2(g) ΔH>0。反应中CO2的浓度(c)随时间(t)的变化关系如图所示。
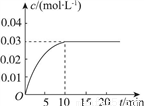
回答下列问题:
(1)下列叙述能判断该反应达到平衡状态的是________(填序号)。
①H2O的质量不再变化
②混合气体的总压强不再变化
③CO、H2O、CO2、H2的浓度都相等
④单位时间内生成amolCO,同时生成amolH2
(2)0~10min时段,反应速率v(H2)=________;反应达到平衡时,c(H2O)=________,CO的转化率为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com