
下列物质的转化在给定条件下能实现的是
A.Fe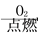 Fe2O3
Fe2O3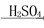 Fe2(SO4)3
Fe2(SO4)3
B.MgO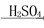 MgSO4(aq)
MgSO4(aq)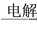 Mg
Mg
C.饱和NaCl(aq)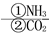 NaHCO3
NaHCO3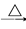 Na2CO3
Na2CO3
D.NH3 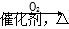 NO
NO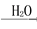 HNO3
HNO3
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:推断题
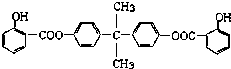
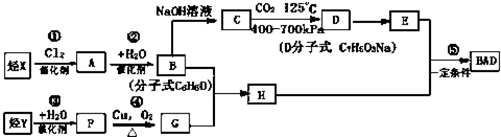
 .
. .F+E
.F+E .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌与稀硫酸反应:Zn+2H+═Zn2++H2↑ | |
| B. | FeCl3溶液中加入氢氧化钠溶液:Fe3++3OH-═Fe(OH)3(胶体) | |
| C. | Ca(NO3)2溶液中滴加少量的Na2CO3溶液:Ca2++CO32-═CaCO3↓ | |
| D. | 常温下氯气与苛性钠溶液反应:Cl2+2OH-═Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源:2017届江苏省如皋市高三上学期质量调研一化学试卷(解析版) 题型:填空题
将不可再生的天然气、石油、煤等化石燃料转化利用、变废为宝已成为当务之急。
(1)根据键能数据估算CH4+4F2=CF4+4HF的反应热ΔH= 。
化学键 | C—H | C—F | H—F | F—F |
键能/(kJ·mol-1) | 414 | 489 | 565 | 155 |
(2)甲醇、二甲醚(CH3OCH3)被称为21世纪的新型燃料,均可利用CO和H2反应合成。
①某燃料电池以二甲醚为原料,熔融碳酸盐为电解质,其负极反应如下:
CH3OCH3+6CO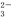 -12e-=8CO2+3H2O。写出该燃料电池的正极反应式: 。
-12e-=8CO2+3H2O。写出该燃料电池的正极反应式: 。
②废水中含甲醇对水质会造成污染,Co3+可将甲醇氧化为CO2。某同学以Pt作电极电解酸性含甲醇废水与CoSO4混合液模拟工业除污原理,其阳极反应式为 。
(3)某企业采用如图所示原理处理化石燃料开采、加工过程产生的H2S废气。
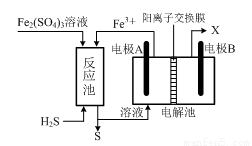
①电解池中电极A、B均为惰性电极,其中A为电解池的 极;电极B所得到的物质X的分子式为 。
②反应池中发生的离子反应方程式为 。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省如皋市高三上学期质量调研一化学试卷(解析版) 题型:选择题
下列图示与对应的叙述相符的是
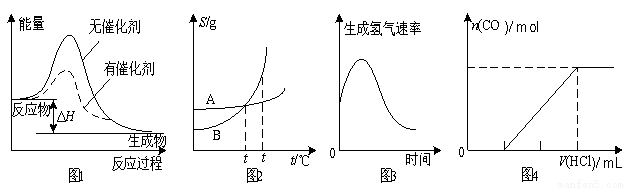
A.图1表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图2表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
C.图3表示镁条放入盐酸中生成氢气速率随时间的变化,起初反应速率加快的原因可能是该反应为放热反应
D.图4表示在含等物质的量NaOH、Na2CO3的混合溶液中滴加0.1 mol·L-1盐酸至过量时,产生气体的体积与消耗盐酸的关系
查看答案和解析>>
科目:高中化学 来源:2017届江苏省如皋市高三上学期质量调研一化学试卷(解析版) 题型:选择题
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子最外层比次外层多3个电子;Y、Z均为金属,Y是同周期中原子半径最大的元素,Z的简单离子半径在同周期元素中最小;W的最高价氧化物在无机含氧酸中酸性最强。下列说法正确的是
A. X的气态氢化物的热稳定性比O(氧)的强
B. 元素Z、W的简单离子具有相同的电子层结构
C. Y、Z、W的最高价氧化物对应的水化物之间能相互反应
D. 等质量的Y和Z单质分别与足量稀盐酸反应,前者产生的氢气多
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
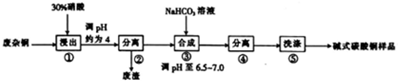
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 保存FeCl3溶液时,可加入少量NaOH,抑制Fe3+水解 | |
| B. | 1molMg在空气中完全燃烧生成MgO和少量Mg3N2,转移的电子数为2NA | |
| C. | 加入铝粉能产生H2的溶液中可以大量存在Fe2+、Na+、SO42-、ClO-四种离子 | |
| D. | 向硫酸氢铵溶液中滴加少量NaOH溶液时发生反应的离子方程式:H++NH4++20H-═NH3•HzO+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
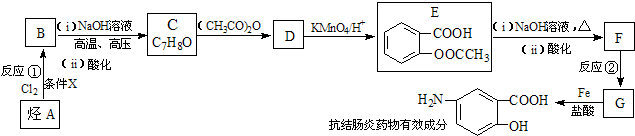
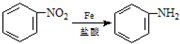
 ;
;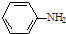 )易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此按先后顺序写出以A为原料合成邻氨基苯甲酸(
)易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此按先后顺序写出以A为原料合成邻氨基苯甲酸( 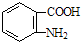 )合成路线中两种中间产物的结构简式(部分反应条件已略去)
)合成路线中两种中间产物的结构简式(部分反应条件已略去)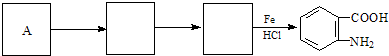
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com