
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值.下列说法正确的是( )
|
| A. | 1L 1mol•L﹣1的NaClO 溶液中含有ClO﹣的数目为NA |
|
| B. | 标准状况下,一定量的铜与硝酸反应后生成22.4 L NO、NO2、N2O4的混合气体,则被还原的硝酸的分子数大于NA |
|
| C. | 铁做电极电解食盐水,若阴极得到NA个电子,则阳极产生11.2L气体(标况下) |
|
| D. | 标准状况下,6.72L NO2与水充分反应转移的电子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组在实验室条件下以硫酸铜溶液为电解液,用电解的方法实现了粗铜(含有少量的锌、铁、银、金等金属和少量矿物杂质)的提纯,并对阳极泥和电解液中金属进行回收和含量测定。请回答以下问题。
(1)电解时,粗铜应与电源的 极相连,阴极上的电极反应式为 ;电解过程中,硫酸铜的浓度会 (选填“变大”“不变”或“变小”)。
(2)电解完成后,该小组同学将电解液过滤后对滤液和阳极泥分别进行处理:
①阳极泥的综合利用:稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式: 。
②Cu的回收、滤液成分及含量的测定:以下是该小组设计的一个实验流程。
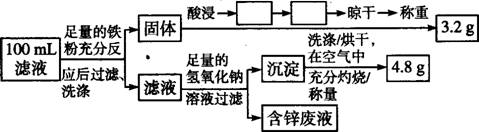
在上述流程中空格内填上相应的操作: 、 ;100 mL滤液中Cu2+的浓度为 mol/l,Fe2+的浓度为 mol/l。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,在容积为10L的密闭容器中,将l mol X和1 mol Y进行如下反应:
2X(g)+Y(g)  Z(g),经60 s达到平衡生成0.3 mol的Z,下列说法正确的是( )
Z(g),经60 s达到平衡生成0.3 mol的Z,下列说法正确的是( )
A.60 s内X的平均反应速率为0.001 mol·L-1·s-1
B.将容器的容积变为20 L,Z的新平衡浓度将等于原平衡浓度的1/2
C.若温度和体积不变,往容器内增加1 mol X,Y的转化率将增大
D.若升高温度,X的体积分数增大,则正反应的△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
图表法、图像法是常用的科学研究方法。
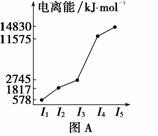

(1)图A是研究短周期某主族元素M的电离能变化情况的图像。则M元素位于元素周期表的第 族。
(2) 图B是研究部分元素氢化物的沸点变化规律的图像,每条折线表示元素周期表ⅣA~ⅦA族中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的氢化物的分子式为 ,A、B、C折线中第二周期元素的气态氢化物的沸点显然高于第三周期元素气态氢化物的沸点,其原因是 。
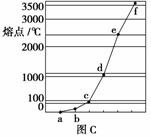
(3)图C是研究Na、Cu、Si、H、C、N等元素单质的熔点高低顺序的图像,其中c、d均是热和电的良导体。单质a、b、f对应的元素以原子个数比1:1:1形成的分子中含有
个σ键和 个π键。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数,下列说法不正确的是
A.标准状况下C2H4气体22.4L,所含电子数为16NA
B.0.1mol铁在纯氧中充分燃烧,失电子数为0.3NA
C.1L 0.2mol/L的氯化铁溶液中,氯离子数为0.6NA
D.室温下,16g甲烷含有共价键数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
将磁性氧化铁放入稀HNO3中可发生如下反应: 3Fe3O4+28HNO3 = 9Fe(NO3)x+NO↑ +14H2O,下列判断合理的是
A.Fe(NO3)x中的x为2
B.稀HNO3在反应中只表现氧化性
C.磁性氧化铁中的所有铁元素全部被氧化
D.反应中每还原0.3mol氧化剂,就有0.9mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
右图是一款笔记本电脑所用甲醇燃料电池的结构示意图。
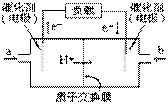
甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为:
2CH3OH+3O2 = 2CO2+4H2O 下列说法正确的是( )
A.右电极为电池的正极,b处通入的物质是空气
B.左电极为电池的负极,a处通入的物质是空气
C.正极反应式为:CH3OH+H2O-6e- = CO2+6H+
D.正极反应式为:O2+2H2O+4e-=4OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com