
【题目】碘化钾可用于有机合成、制药等,它是一种白色立方结晶或粉末,易溶于水。实验室制备KI 的实验装置如下

实验步骤如下:
①在上图所示的C中加入 127g 研细的单质I2 和 195g 30%的 KOH 溶液,剧烈搅拌。
②I2完全反应后,打开弹簧夹向其中通入足量的 H2S。
③将装置 C 中所得溶液用稀 H2SO4酸化后,置于水浴上加热 10min。
④在装置 C 的溶液中加入 BaCO3 ,充分搅拌后,过滤、洗涤。
⑤将滤液用氢碘酸酸化,蒸发浓缩至表面出现结晶膜, 、 、洗涤、干燥。
⑥得产品 145g。
回答下列问题;
(1)步骤①将碘研细的目的是_____________________________________。
(2)装置A 中发生反应的离子方程式为_______________________________ ;装置 B 中的试剂是____________________,C装置的名称是_____________。
(3)装置 C 中I2与 KOH 反应产物之一是 KIO3 ,该反应的化学方程式为_______________。
(4)步骤④的目的是___________________________________ 。
(5)补充完整步骤⑤ __________________、_______________。
(6)本次实验产率为__________________ (保留四位有效数字)。
【答案】增大反应物的接触面积,提高反应速率,使反应更充分; FeS+2H+=Fe2++H2S↑ 饱和硫氢化钠溶液 三颈烧瓶 3I2+6KOH=KIO3+5KI+3H2O 除去产品中的硫酸根(硫酸盐、硫酸) 降温结晶 过滤 87.35%
【解析】
A装置用来制备H2S气体,B装置用于除去H2S中的HCl气体,C是KI的生成装置,H2S与KIO3反应,D装置用于尾气处理;
(1)步骤①将碘研细的目的是增大反应物的接触面积,提高反应速率,使反应更充分,
故答案为:增大反应物的接触面积,提高反应速率,使反应更充分;
(2)装置A 中FeS与盐酸反应生成H2S气体,发生反应的离子方程式为FeS+2H+=Fe2++H2S↑,除去硫化氢气体中混有的HCl气体,最好选用饱和硫氢化钠溶液,则装置 B 中的试剂是饱和硫氢化钠,C装置是三颈烧瓶,
故答案为:FeS+2H+=Fe2++H2S↑,饱和硫氢化钠溶液,三颈烧瓶;
(3)装置 C 中I2与 KOH 反应生成KI、 KIO3和水 ,该反应的化学方程式为3I2+6KOH=KIO3+5KI+3H2O,
故答案为:3I2+6KOH=KIO3+5KI+3H2O;
(4)步骤④是为了除去装置C中的SO42-,使之形成BaSO4沉淀,
故答案为:除去产品中的硫酸根(硫酸盐、硫酸);
(5)步骤⑤中将得到的KI分离提纯出来需要降温结晶和过滤,
故答案为:降温结晶、过滤;
(6)本次实验生成产品145g,根据提示可知I2完全反应后,I原子守恒,2n(I2)=n(KI)=1mol,即m(KI)=1mol×166g/mol=166g,产率为![]() ×100%=87.35%,
×100%=87.35%,
故答案为:87.35%。


 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述不正确的是
A.1.8g 15NH3含有的电子数为NA
B.1L 0.1 mol·L-1硫酸钠溶液中含有的氧原子数为0.4NA
C.常温常压下,8g硝酸铵中含有的氮原子数为0.2NA
D.通常状况下,22.4LCO2和CO的混合气体,其物质的量小于1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对羟基扁桃酸是农药、药物、香料合成的重要中间体,它可由苯酚和乙醛酸在一定条件下反应制得:
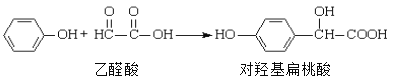
下列说法不正确的是
A. 上述反应的原子利用率可达到100%
B. 在核磁共振氢谱中对羟基扁桃酸应该有6个吸收峰
C. 1mol对羟基扁桃酸与足量NaOH溶液反应,消耗3 mol NaOH
D. 可以用FeCl3溶液鉴别乙醛酸和苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,超氧化钾晶体呈立方体结构.晶体中氧的化合价部分为0价,部分为﹣2价.如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元).则下列说法正确的是( )

A. 超氧化钾的化学式为KO2,每晶胞含有14个K+和13个O2﹣
B. 晶体中每个K+周围有8个O2﹣,每个O2﹣周围有8个K+
C. 晶体中与每个K+距离最近的K+有8个
D. 晶体中,0价氧原子与﹣2价氧原子的数目比为3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应按照不同的分类方法,可以分为化合反应、分解反应、置换反应、复分解反应,也可分为氧化还原反应和非氧化还原反应、离子反应和非离子反应。有下列反应:
①CO2+C![]() 2CO ②Cu2(OH)2CO3
2CO ②Cu2(OH)2CO3![]() 2CuO+H2O+CO2↑
2CuO+H2O+CO2↑
③2NaOH+Cl2=NaCl+NaClO+H2O ④2CO+O2![]() 2CO2
2CO2
⑤3Fe+4H2O(g)![]() Fe3O4+4H2 ⑥CuO+H2
Fe3O4+4H2 ⑥CuO+H2![]() Cu+H2O
Cu+H2O
⑦2H2O![]() 2H2↑+O2↑ ⑧CO2+H2O=H2CO3
2H2↑+O2↑ ⑧CO2+H2O=H2CO3
(1)其中属于化合反应的有_____________(填序号,下同),属于置换反应的有_____________。
(2)在化学反应前后元素的化合价没有变化的是_______________________。
(3)上述反应中,既是分解反应,又是氧化还原反应的是_____________________。
(4)上述反应中,既是溶液中的离子反应,又是氧化还原反应的是__________。
(5)根据你的理解,氧化还原反应的实质是(___________)
A.分子中的原子重新组合 B.氧元素的得失
C.电子的得失或共用电子对的偏移 D.化合价的改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍与VA族元素形成的化合物是重要的半导体材料,应用最广泛的是砷化镓(GaAs),回答下列问题:
(1)基态Ga原子的核外电子排布式为_____,基态As原子核外有_________个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1984.5、2961.8、6192由此可推知镓的主要化合价为____和+3。砷的电负性比镍____(填“大”或“小”)。
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:________________________。
镓的卤化物 | GaCl3 | GaBr3 | GaI3 |
熔点/℃ | 77.75 | 122.3 | 211.5 |
沸点/℃ | 201.2 | 279 | 346 |
GaF3的熔点超过1000 ℃,可能的原因___________________________________________。
(4)二水合草酸镓的结构如图所示,其中镓原子的配位数为______,草酸根中碳原子的杂化方式为______________。

(5)砷化镓熔点为1238℃,立方晶胞结构如图所示,晶胞参数为a=565 pm。该晶体的类型为_________,晶体的密度为___________(设NA为阿伏加德罗常数的数值,列出算式即可)g·cm-3。

查看答案和解析>>
科目:高中化学 来源: 题型:
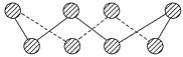
【题目】(1)S单质的常见形式为S8,其环状结构如图所示,S原子采用的轨道杂化方式是_______。
(2)H2Se的酸性比H2S________ (填“强”或“弱”)。气态SeO3分子的立体构型为________,SO32-离子的立体构型为________。
(3)用价层电子对互斥理论推断SnBr2分子中Sn—Br的键角________120°(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示实验装置进行相应实验,能达到实验目的的是( )

A. 用图甲所示装置,蒸干AlCl3饱和溶液制备AlCl3晶体
B. 按装置乙所示的气流方向可用于收集H2、NO等
C. 用图丙所示装置,分离CCl4萃取碘水后的有机层和水层
D. 用图丁所示装置,可以证明氧化性:Cl2>Br2>I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸是生物油的主要成分之一,乙酸制氢具有重要意义:
热裂解反应CH3COOH(g)→2CO(g)+2H2(g) △H=+2l3.7KJ·mol-1
脱酸基反应CH3COOH(g)→CH4(g)+CO2(g) △H=-33.5KJ·mol-1
(1)请写出CO与H2甲烷化的热化学方程式_________________________________。
(2)在密闭容器中,利用乙酸制氢,选择的压强为___________(填“较大”或“常压”)。其中温度与气体产率的关系如图:
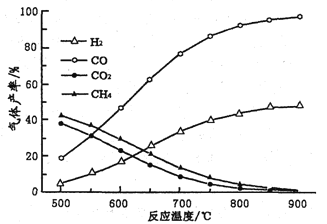
①约650℃之前,脱酸基反应活化能低速率快,故氢气产率低于甲烷;650℃之后氢气产率高于甲烷,理由是随着温度升高后,热裂解反应速率加快,同时______________________。
②保持其他条件不变,在乙酸气中掺杂一定量水,氢气产率显著提高而CO的产率下降,请用化学方程式表示:_________________________________。
(3)若利用合适的催化剂控制其他的副反应,温度为TK时达到平衡,总压强为PkPa,热裂解反应消耗乙酸20%,脱酸基反应消耗乙酸60%,乙酸体积分数为___________(计算结果保留l位小数);脱酸基反应的平衡常数Kp为___________kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com