
【题目】室温下,某碳酸溶液中的H2CO3、HCO3-、CO23-的物质的量分数δ随pH的变化如下图所示。下列叙述错误的是( )
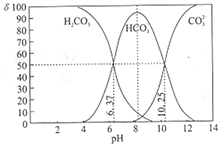
A. 当溶液中δ(HCO3-)达到最大时:c(H2CO3)>c(CO32-)
B. Ka2(H2CO3)的数量级为10-11
C. 调节溶液的pH由8~10的过程中![]() 减小
减小
D. 加入NaOH使溶液pH=9时,主要反应为HCO3-+OH-=CO32-+H2O
【答案】C
【解析】根据图像可知,当溶液中δ(HCO3-)达到最大时,溶液pH=8,溶液显碱性,HCO3-的水解过程大于电离过程,因此c(H2CO3)>c(CO32-),A正确;Ka2(H2CO3)=c(CO32-)×c(H+)/c(HCO3-),根据图像可知,c(CO32-)=c(HCO3-)时,c(H+)=10-10.25mol/L,Ka2(H2CO3)= 10-10.25,所以Ka2(H2CO3)的数量级为10-11,B正确;针对![]() ,分子分母同乘以c(H+),变为KW/c(H+)×c(CO32-),此式分子分母同乘以1/c(HCO3-)变为=KW/[Ka2×c(HCO3-)]=
,分子分母同乘以c(H+),变为KW/c(H+)×c(CO32-),此式分子分母同乘以1/c(HCO3-)变为=KW/[Ka2×c(HCO3-)]=![]() ,从图像可知,调节溶液的pH由8~10的过程中,c(HCO3-)减小,所以
,从图像可知,调节溶液的pH由8~10的过程中,c(HCO3-)减小,所以![]() 增大,C错误;加入NaOH使溶液pH=9时,溶液中HCO3-与OH-发生反应:HCO3-+OH-=CO32-+H2O,D正确;正确选项C。
增大,C错误;加入NaOH使溶液pH=9时,溶液中HCO3-与OH-发生反应:HCO3-+OH-=CO32-+H2O,D正确;正确选项C。


科目:高中化学 来源: 题型:
【题目】索氏提取法是测定动植物样品中粗脂肪含量的标准方法。其原理是利用如图装置,用无水乙醚等有机溶剂连续、反复、多次萃取动植物样品中的粗脂肪。具体步骤如下:

①包装:取滤纸制成滤纸筒,放入烘箱中干燥后,移至仪器X中冷却至室温。然后放入称量瓶中称量,质量记作a;在滤纸筒中包入一定质量研细的样品,放入烘箱中干燥后,移至仪器X中冷却至室温,然后放入称量瓶中称量,质量记作b。
②萃取:将装有样品的滤纸筒用长镊子放入抽提筒中,注入一定量的无水乙醚,使滤纸筒完全浸没入乙醚中,接通冷凝水,加热并调节温度,使冷凝下滴的无水乙醚呈连珠状,至抽提筒中的无水乙醚用滤纸点滴检查无油迹为止(大约6h~12h)。
③称量:萃取完毕后,用长镊子取出滤纸筒,在通风处使无水乙醚挥发,待无水乙醚挥发后,将滤纸筒放入烘箱中干燥后,移至仪器X中冷却至室温,然后放入称量瓶中称量,质量记作c。
回答下列问题:
(1)实验中使用了三次的仪器X的名称___________。为提高乙醚蒸气的冷凝效果,索氏提取器可选用下列______(填字母)代替。
a. 空气冷凝管![]() b.直形冷凝管
b.直形冷凝管![]()
C.蛇形冷凝管![]()
(2)①实验中必须十分注意乙醚的安全使用,如不能用明火加热、室内保持通风等。为防止乙醚挥发到空气中形成燃爆,常在冷凝管上口连接一个球形干燥管,其中装入的药品为___(填字母)。
a.活性炭 b.碱石灰 c:P2O5 d.浓硫酸
②无水乙醚在空气中可能氧化生成少量过氧化物,加热时发生爆炸。检验无水乙醚中是否含有过氧化物的方法是______________________。
(3)①实验中需控制温度在70℃~80℃之间,考虑到安全等因素,应采取的加热方式是_____。
②当无水乙醚加热沸腾后,蒸气通过导气管上升,被冷凝为液体滴入抽提筒中,当液面超过回流管最高处时,萃取液即回流入提取器(烧瓶)中……该过程连续、反复、多次进行,则萃取液回流入提取器(烧瓶)的物理现象为________。
A.冷凝回流 B.虹吸 C.倒吸 D.分液
③索氏提取法与一般萃取法相比较,其优点为_______________。
(4)数据处理: 样品中纯脂肪百分含量_______(填“<”、“>”或“=”)![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖类、油脂、蛋白质是人类重要的营养物质。下列有关这三类物质的说法正确的是
A.均是天然高分子化合物B.均只由C、H、O三种元素组成
C.油脂的水解反应又叫皂化反应D.淀粉、油脂、蛋白质在一定条件下均能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为利用肼(N2H4)一空气燃料电池电解硫酸铜溶液的示意图。下列说法正确的是( )
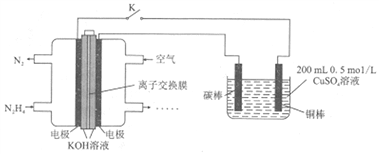
A. 左图中离子交换膜为阳离子交换膜
B. 左图负极反应式为:N2H4-6e-+4OH-=N2↑+4H2O
C. 闭合开关K一段时间后,左图电池中电解质溶液的pH不变
D. 当右图阴极上析出4.48L气体(标准状况)时,消耗0.15molN2H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,BaSO4饱和溶液中加少量的BaCl2溶液产生BaSO4沉淀,若以Ksp表示该温度下BaSO4的溶度积常数,则平衡后的溶液中
A. c(Ba2+)=c(SO42-)=![]() B. c(Ba2+)·c(SO42-)>Ksp,c(Ba2+)=c(SO42-)
B. c(Ba2+)·c(SO42-)>Ksp,c(Ba2+)=c(SO42-)
C. c(Ba2+)·c(SO42-)=Ksp,c(Ba2+)>c(SO42-) D. c(Ba2+)·c(SO42-)≠Ksp,c(Ba2+)<c(SO42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在工农业生产、生活中有着重要应用。
(1)氯胺[NH2Cl(g)]是一种长效缓释含氯消毒剂,有缓慢而持久的杀菌作用,试写出其杀菌过程中与水反应的化学方程式________________。
(2)羟胺(NH2OH)是有机合成的常见还原剂。工业上可用硝酸.硫酸水溶液作电解质进行电解,在汞电极上NO3-可转化为NH2OH,以铂为另一极,则该电解反应的总化学方程式为________________。
(3)银氨溶液是检验醛基的重要试剂,其溶液中存在Ag(NH3)2+(aq)![]() Ag+(aq)+2NH3(aq)。常温下,反应AgCl(s)+2NH3(aq)
Ag+(aq)+2NH3(aq)。常温下,反应AgCl(s)+2NH3(aq)![]() Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=1.94×10-3,且Ksp(AgCl)=1.76×10-10,则K[Ag(NH3)2+]=________________。
Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=1.94×10-3,且Ksp(AgCl)=1.76×10-10,则K[Ag(NH3)2+]=________________。
(4)水合肼(N2H4·H2O)常用作锅炉水的除氧剂。N2H4·H2O为二元弱碱,在水溶液中的一级电离方程式表示为N2H4·H2O![]() N2H5++OH-。盐酸肼(N2H6Cl2)是一种可溶性盐,其第一步水解的离子方程式为________________,溶液中离子浓度由大到小的排列顺序为________________。
N2H5++OH-。盐酸肼(N2H6Cl2)是一种可溶性盐,其第一步水解的离子方程式为________________,溶液中离子浓度由大到小的排列顺序为________________。
(5)氨是一种重要的氮肥。工业合成氨反应为:![]() N2(g)+
N2(g)+ ![]() H2(g)
H2(g)![]() NH3(g),该反应的活化能Ea1=254kJ/mol。
NH3(g),该反应的活化能Ea1=254kJ/mol。
①查阅文献,相关化学键键能数据如下:
化学键 | H-H | N | N-H |
E/kJ·mol-1 | 436 | 946 | 391 |
则反应NH3(g)![]()
![]() N2(g)+
N2(g)+ ![]() H2(g)的活化能Ea2=________________。
H2(g)的活化能Ea2=________________。
②一定条件下,1molN2与3.6molH2在密闭容器中充分反应,测得放出的热量为13.8kJ,则H2的转化率为________________,为提高原料的利用率,工业合成氨应该采取的措施是=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,下列做法有利于环境保护和可持续发展的是( )
A.大量生产一次性超薄塑料袋方便日常生活
B.对所有垃圾以直接露天焚烧的方式进行处理
C.加大农药和化肥的生产和使用量,以提高粮食的产量
D.推行绿色设计、绿色工艺、开发绿色产品,从源头上消除污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一块金属钠露置于空气中,观察到下列现象:
![]()
请回答下列问题:
(1)白色粉末的化学式是__________,过程②的化学方程式是_________。
(2)下列说法正确的是________。
A. 过程③为物理变化
B. 过程④是碳酸钠吸收空气中的CO2、水蒸气形成了碳酸氢钠
C. 过程⑤发生了分解反应
D. 整个变化过程中只有一个氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知100 kPa、298.15 K时氢氟酸的电离过程HF(aq)H+(aq)+F-(aq) ΔH=-12.5kJ·mol-1,ΔS=-102.5 J·mol-1·K-1,试判断该过程的自发性( )
A. 可自发进行 B. 不能自发进行 C. 达到平衡 D. 不能判定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com