
| A.含有共价键的化合物一定是共价化合物 |
| B.含有离子键的化合物一定是离子化合物 |
| C.在离子化合物中可能存在共价键 |
| D.在共价化合物中不可能存在离子键 |
科目:高中化学 来源:不详 题型:填空题
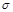 键数目为 。
键数目为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素编号 | 元素性质或原子结构 |
| A | 第三周期中的半导体材科 |
| B | L层s电子数比p电子数少l |
| C | 地壳中含量最高的元素 |
| D | 第三周期主族元素中其第一电离能最大 |
| E | 第四周期中未成对电子数最多 |
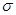 键和 个
键和 个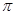 键。元素B的气态氢化的空间构型
键。元素B的气态氢化的空间构型查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
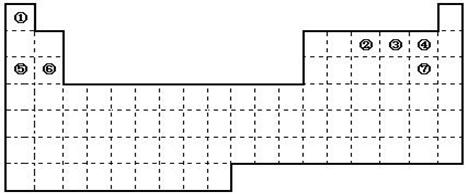
| A.周期表中的元素⑤和元素⑥的最高价氧化物的水化物碱性强弱顺序是(用化学式表示)。 |
| B.周期表中的元素④和元素⑦的氢化物的熔、沸点高低顺序是(用化学式表示)。 |
| C.①~⑦元素的单质,在常温下化学性质稳定,通常可用作保护气的是(填写结构式)。 |
| D.在上面元素周期表中全部是金属元素的主族是;全部是非金属元素的主族是(填写字母a、b、c、d)。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | A | B | C | D | E | F | G | H | I | J |
| 原子半径(10-9m) | 0.074 | 0.160 | 0.152 | 0.110 | 0.099 | 0.186 | 0.075 | 0.082 | 0.102 | 0.037 |
| 最高或最低 化合价 | | +2 | +1 | +5 | +7 | +1 | +5 | +3 | +6[ | +1 |
| -2 | | | -3 | -1 | | -3 | | -2 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1S2 | B.2S2 | C.3S2 | D.4S2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.一个D2O分子所含中子数为8 | B.NH3的结构式为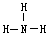 |
C.HCl的电子式为 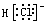 | D.沸点: HF> H2O >NH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com