
【题目】配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏低的原因是( )
A.未洗涤烧杯和玻璃棒
B.转移溶液前溶液未冷却至室温
C.容量瓶未干燥
D.定容时俯视液面
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. 将过量的稀盐酸逐滴滴入稀Na2CO3溶液中,立即产生气体
B. FeCl3溶液能与Cu 反应,可用于蚀刻印刷电路
C. Cl2能使湿润的有色布条褪色,说明Cl2具有漂白性
D. 用洗气瓶中的NaOH溶液除去CO2中混有的HCl气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有H2O、NH3、CH4三种物质,它们分别都含有1mol氢原子,则三种物质的物质的量之比为
A.1∶1∶1B.6∶4∶3C.4∶3∶2D.6∶3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是大气污染物,造成酸雨的主要原因,用如图所示装置可以既吸收工厂排放的废气中的SO2,又可以生成一定量的硫酸,下列说法正确的是

A. a为正极,b为负极
B. 生产过程中氢离子由右移向左
C. 从左下口流出的硫酸的质量分数一定大于50%
D. 负极反应式为SO2+2H2O-2e-=SO42-+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和深度开发CO、CO2的应用对建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:
Fe2O3(s)+3C(s)=2Fe(s)+3CO(g) ΔH1=+489.0kJmol-1,
C(s)+CO2(g)=2CO(g) △H2=+172.5kJmol-1
则CO还原Fe2O3(s)的热化学方程式为____________________。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式:__________________。
(3)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化见图1。
CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化见图1。
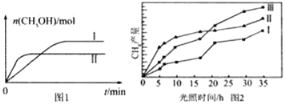
①线Ⅰ、Ⅱ对应的平衡常数大小关系为KI______KⅡ(填“>”或“=”或“<”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物投入量 | 1mol CO2、3mol H2 | a mol CO2、b mol H2、 c mol CH3OH(g)、c molH2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为____________。
(4)利用光能和光催化剂,可将CO2和H2(g)转化为CH4和O2,紫外光照射时,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化见图2。在0~15小时内,CH4的平均生成速率I、Ⅱ和Ⅲ从大到小的顺序为_____________(填序号)
(5)一种甲醇燃料电池,使用的电解质溶液是2mol·L-1的KOH溶液。
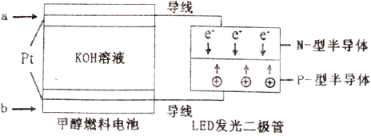
请写出加入(通入)b物质一极的电极反应式________________;每消耗6.4g甲醇转移的电子数为_______________。
(6)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将amol/L的醋酸与bmol/LBa(OH)2溶液等体积混合后,溶液中:2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数Ka为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用18.4 mol·L-1的浓硫酸来配制500mL 0.5 mol·L-1的稀硫酸,可供选择的仪器有:①玻璃棒 ②烧杯 ③胶头滴管 ④量筒 ⑤托盘天平
(1)上述仪器在配制过程中不需要用到的是__________________。(填序号)除上述仪器外,尚缺最重要的仪器是_____________________ 。
(2)计算所需浓硫酸的体积为___________m L(保留1位小数)。
(3)实验中用到玻璃棒,其作用分别是:___________、__________。
(4)配制时,一般可分为以下几个步骤:
①量取 ②计算 ③稀释 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却。其正确的操作顺序 为:②→①→③→____ →____→____→____→④(填序号) ____________
(5)在配制过程中,下列操作可引起所配溶液浓度偏低的有____________(填序号)
①定容时,仰视刻度线。
②未冷却至室温就转移到容量瓶中。
③容量瓶中含有少量蒸馏水。
④未洗涤稀释浓硫酸时用过的烧杯和玻璃棒。
⑤定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C为中学化学中常见的单质。室温下,A为固体,B和C均为气体。在适宜的条件下,它们可以按下面框图进行反应。
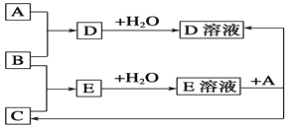
回答下列问题:
(1)A、B、C三种元素中的任意两种元素形成的化合物所属物质类别一定不是_________。
①氢化物 ②酸 ③碱 ④盐 ⑤氧化物
(2)A、B、C三种元素中有一种是金属,则这种元素是A、B、C中的_______,理由是_________________________。
(3)如果E溶液是一种强酸,则E的化学式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在KClO3+6HCl===KCl+3Cl2↑+3H2O中,被氧化与被还原的氯原子个数比为 ( )
A. 1﹕6 B. 6﹕1 C. 1﹕5 D. 5﹕1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如表(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标准状况) | 100 | 240 | 464 | 576 | 620 |
①哪一时间段反应速率最大__________min(填0~1、1~2、2~3、3~4、4~5),原因是__________。
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率__________(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是(_________)
A.蒸馏水 B.KCl溶液 C.KNO3溶液 D.CuSO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图
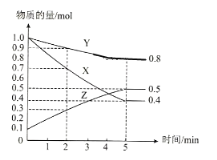
①该反应的化学方程式是__________。
②该反应达到平衡状态的标志是__________。
A X、Y、Z的反应速率相等
B X、Y的反应速率比为3:1
C 容器内气体压强保持不变
D 生成1mol Y的同时生成2mol Z
③2min内X的转化率为__________。
④若上述反应中X、Y、Z分别为H2、N2、NH3,且已知17g氨气分解成氮气和氢气要吸收46kJ热量,则该反应的热化学反应方程式为:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com