
分析 (1)Na2S2O3是一种弱酸强碱盐,溶液中S2O32-离子水解,破坏水的电离平衡,溶液呈碱性;
(2)①根据化合价代数和为0计算Na2S2O3中S元素的化合价;
②由信息可知,I2将S2O32-氧化为S4O62-,I2还原生成I-;
(3)反应中Cl2全部转化为Cl-,氯元素化合价由0价降低为-1价,Na2S2O3中硫元素被氧化,根据电子转移守恒计算氧化产物中S元素化合价,进而确定氧化产物;
(4)①由于酸性溶液中Na2S2O3会分解,而二氧化硫过量,溶于水呈酸性,会使Na2S2O3分解;
②根据硫元素化合价进行分析判断,所含元素化合价升高的反应物为还原剂,发生氧化反应,所含元素化合价降低的反应物为氧化物,发生还原反应.
解答 解:(1)Na2S2O3是一种弱酸强碱盐,溶液中S2O32-离子水解:S2O32-+H2O?HS2O3-+OH-,破坏水的电离平衡,溶液呈弱碱性,
故答案为:弱碱性;S2O32-+H2O?HS2O3-+OH-;
(2)①设Na2S2O3中S元素的化合价为x,化合价代数和为0,则2+2x+(-2)×3=0,解得x=2,故S元素化合价为+2,故答案为:+2;
②由信息可知,I2将S2O32-氧化为S4O62-,I2还原生成I-,反应离子方程式为:I2+S2O32-=S4O62-+2I-,
故答案为:I2+S2O32-=S4O62-+2I-;
(3)反应中Cl2全部转化为Cl-,氯元素化合价由0价降低为-1价,氯元素被还原,Na2S2O3中硫元素被氧化,令硫元素在氧化产物中的化合价为a价,根据电子转移守恒,则:
4mol×2=1mol×2×(a-2),
解得a=+6,即硫元素被氧化为+6价,
故选:D;
(4)①由于酸性溶液中Na2S2O3会分解,而二氧化硫过量,溶液呈酸性,会使Na2S2O3分解,
故答案为:二氧化硫过量,溶液呈酸性,会使Na2S2O3分解;
②反应中Na2S中S元素化合价由-2价升高为Na2S2O3中+2价,发生氧化反应,故Na2S为还原剂,SO2中S元素化合价由+4价降低为Na2S2O3中+2价,发生还原反应,
故答案为:还原;还原.
点评 本题以Na2S2O3为载体,考查了盐类水解、氧化还原反应基本概念与计算、离子方程式书写、物质制备等,属于拼合型题目,注意对题目信息的提取运用,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用稀硫酸除去铜绿:4H++Cu2(OH)2CO3═2Cu2++CO2↑+3H2O | |
| B. | Fe3O4与稀硝酸反应的离子方程式为:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| C. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:2Ba2++NH4++Al3++2SO42-+4OH-═Al(OH)3↓+NH3•H2O+2BaSO4↓ | |
| D. | 少量氢氧化钙溶液与碳酸氢钠溶液混合:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C1:C2=1:3 | B. | 平衡时,X和Z的生成速率之比为1:2 | ||
| C. | X、Y的转化率不相等 | D. | C1的取值范围为0<C1<0.14mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
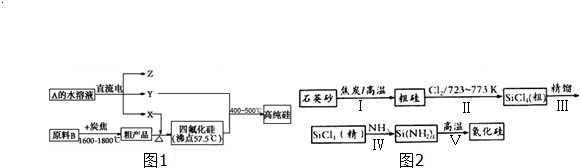
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
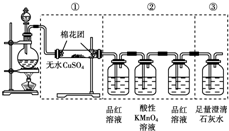
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
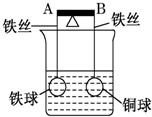 如图杠杆AB两端分别挂着体积相同质量相同的空心铁球和空心铜球.调节杠杆使其保持平衡,一段时间后小心加入浓CuSO4溶液,回答下列有关问题(不考虑铁丝反应和两球的浮力变化)
如图杠杆AB两端分别挂着体积相同质量相同的空心铁球和空心铜球.调节杠杆使其保持平衡,一段时间后小心加入浓CuSO4溶液,回答下列有关问题(不考虑铁丝反应和两球的浮力变化)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
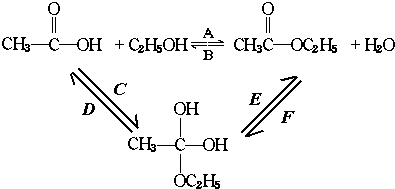
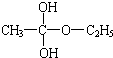 再转化为酯和水,以上反应均为可逆反应,回答下列问题:
再转化为酯和水,以上反应均为可逆反应,回答下列问题: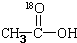 进行该实验,18O可存在于哪些物质中A、C
进行该实验,18O可存在于哪些物质中A、C查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com