
| A£® | Cu2SµÄĦ¶ūÖŹĮæĪŖ160 | |
| B£® | ĆæÉś²ś1molCuŠč×ŖŅĘ2molµē×Ó | |
| C£® | øĆ·“Ó¦ÖŠCu2S¼ČŹĒŃõ»Æ¼ĮÓÖŹĒ»¹Ō¼Į | |
| D£® | ČōÓĆøĆ·“Ӧɜ²śĶ£¬Č«ŹĄ½ēĆæÄź²śÉśµÄSO2µÄĢå»żĪŖ1.4”Į106L |
·ÖĪö Cu2S+O2$\frac{\underline{\;øßĪĀ\;}}{\;}$2Cu+SO2ÖŠ£¬CuŌŖĖŲµÄ»ÆŗĻ¼ŪÓÉ+1¼Ū½µµĶĪŖ0£¬OŌŖĖŲµÄ»ÆŗĻ¼ŪÓÉ0½µµĶĪŖ-2¼Ū£¬SŌŖĖŲµÄ»ÆŗĻ¼ŪÓÉ-2¼ŪÉżøßĪŖ+4¼Ū£¬ŅŌ“ĖĄ“½ā“š£®
½ā“š ½ā£ŗA£®Ä¦¶ūÖŹĮæÓŠµ„Ī»g/mol£¬ĖłŅŌCu2SµÄĦ¶ūÖŹĮæĪŖ160g/mol£¬¹ŹA“ķĪó£»
B£®ĆæÉś²ś1molCu£¬0.5molSŹ§Č„µē×Ó£¬Šč×ŖŅĘ0.5mol”Į[4-£Ø-2£©]=3molµē×Ó£¬¹ŹB“ķĪó£»
C£®CuŌŖĖŲµÄ»ÆŗĻ¼Ū½µµĶ£¬SŌŖĖŲµÄ»ÆŗĻ¼ŪÉżøߣ¬ŌņCu2S¼ČŹĒ»¹Ō¼ĮÓÖŹĒŃõ»Æ¼Į£¬¹ŹCÕżČ·£»
D£®Č«ŹĄ½ēĆæÄźĶµÄ²śĮæĪŖ8”Į106t£¬ÓÉ·“Ó¦æÉÖŖ£¬Cu”¢SO2µÄĪļÖŹµÄĮæ±ČĪŖ2£ŗ1£¬ŅŌ“ĖæɼĘĖćĘäĪļÖŹµÄĮ棬µ«×“æöĪ“ÖŖ£¬²»ÄܼĘĖćĘäĢå»ż£¬¹ŹD“ķĪó£»
¹ŹŃ”C£®
µćĘĄ ±¾Ģāæ¼²éŃõ»Æ»¹Ō·“Ó¦£¬ĪŖøßæ¼³£¼ūĢāŠĶ£¬°ŃĪÕ·“Ó¦ÖŠŌŖĖŲµÄ»ÆŗĻ¼Ū±ä»ÆĪŖ½ā“šµÄ¹Ų¼ü£¬²ąÖŲŃõ»Æ»¹Ō·“Ó¦»ł±¾øÅÄīŗĶ×ŖŅʵē×ÓŹżÄæµÄæ¼²é£¬Ń”ĻīDĪŖŅדķµć£¬ĢāÄæÄŃ¶Č²»“ó£®


 Š”ѧ½Ģ²ÄĶźČ«½ā¶ĮĻµĮŠ“š°ø
Š”ѧ½Ģ²ÄĶźČ«½ā¶ĮĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | µāµ„ÖŹŹÜČČŅ×Éż»Ŗ£¬ÓĆ¼ÓČČ·ØæÉŅŌ·ÖĄėøßĆĢĖį¼ŲŗĶµāµ„ÖŹµÄ»ģŗĻĪļ | |
| B£® | ·ÖŅŗŹ±£¬·ÖŅŗĀ©¶·ÄŚµÄÉĻĻĀ²ćŅŗĢåÓ¦·Ö±š¶¼“ÓĻĀæŚ·Å³ö | |
| C£® | ĻņäåĖ®ÖŠ¼ÓČė±½£¬³ä·ÖÕńµ“ŗó¾²ÖĆ£¬ÉĻ²ćĪŽÉ«£¬ĻĀ²ć³ČŗģÉ« | |
| D£® | ÅäÖĘ100 g10%µÄCuSO4ČÜŅŗ£¬³ĘČ”10 gĮņĖįĶ¹ĢĢåČÜÓŚ90 gĖ®ÖŠ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 ŃŠ¾æCO”¢NO”¢NO2µČĘųĢåµÄŠŌÖŹ£¬ŅŌ±ćĻū³żĪŪČ¾»ņ±ä·ĻĪŖ±¦£¬æÉŅŌ±£»¤»·¾³”¢½ŚŌ¼×ŹŌ“£®ŹŌŌĖÓĆĖłŃ§ÖŖŹ¶£¬½ā¾öĻĀĮŠĪŹĢā£ŗ
ŃŠ¾æCO”¢NO”¢NO2µČĘųĢåµÄŠŌÖŹ£¬ŅŌ±ćĻū³żĪŪČ¾»ņ±ä·ĻĪŖ±¦£¬æÉŅŌ±£»¤»·¾³”¢½ŚŌ¼×ŹŌ“£®ŹŌŌĖÓĆĖłŃ§ÖŖŹ¶£¬½ā¾öĻĀĮŠĪŹĢā£ŗ| ĪĀ¶Č/”ę | 400 | 500 | 800 |
| Ę½ŗā³£ŹżK | 9.945795506 | 9 | 1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¼ĘĖćĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | µŚŅ»µēĄėÄÜ£ŗYŠ”ÓŚX | |
| B£® | ĘųĢ¬Ēā»ÆĪļµÄĪČ¶ØŠŌ£ŗHmYĒæÓŚHnX | |
| C£® | ×īøß¼Ūŗ¬ŃõĖįµÄĖįŠŌXČõÓŚY | |
| D£® | XŗĶYŠĪ³É»ÆŗĻĪļŹ±£¬XĻŌøŗ¼ŪYĻŌÕż¼Ū |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĶʶĻĢā
 £®
£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
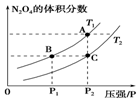
| ŹµŃ鱹ŗÅ | ĪĀ¶Č/”ę | ĘšŹ¼Įæ/mol | Ę½ŗāĮæ/mol | “ļµ½Ę½ŗāĖłŠčŹ±¼ä/min | ||
| SO2 | O2 | SO2 | O2 | |||
| 1 | T1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | 4 | 2 | 0.4 | y | 9 |
| A£® | x=1.6 | |
| B£® | ŹµŃé 1 ŌŚĒ° 6min µÄ·“Ó¦ĖŁĀŹ v£ØSO2£©=0.2mol•L-1•min-1 | |
| C£® | T1”¢T2µÄ¹ŲĻµ£ŗT1£¾T2 | |
| D£® | K1”¢K2µÄ¹ŲĻµ£ŗK1£¾K2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com