
|
3 g镁铝合金与100 mL稀硫酸恰好完全反应,将反应后的溶液加热蒸干,得到无水硫酸盐17.4 g,则原硫酸的物质的量浓度为 | |
| [ ] | |
A. |
1 mol·L-1 |
B. |
1.5 mol·L-1 |
C. |
2 mol·L-1 |
D. |
2.5 mol·L-1 |
科目:高中化学 来源: 题型:阅读理解
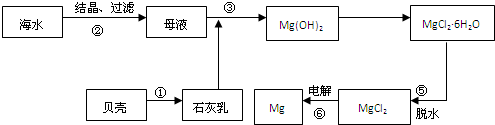
 镁将成为21世纪重要的轻型环保材料.
镁将成为21世纪重要的轻型环保材料.| 熟石灰 |
| 过滤 |
| 盐酸 |
| 蒸发、浓缩、结晶 |
| 脱水 |
| 通电 |
| 所加氢氧化钠溶液的次数 | 第一次 | 第二次 | 第三次 |
| 剩余固体的质量/g | 10.6 | 5.2 | 4.0 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 所加氢氧化钠溶液的次数 | 第一次 | 第二次 | 第三次 |
| 剩余固体的质量/g | 10.6 | 5.2 | 4.0 |
查看答案和解析>>
科目:高中化学 来源:2012届海南省琼海市嘉积中学高三上学期教学质量监测(一)化学试卷 题型:计算题
(6分)把10.2 g镁铝合金的粉末放入过量的盐酸中,得到11.2 L H2(标准状况下)。试
计算:(原子量:Mg—24、Al—27)
(1)该合金中镁的质量分数。
(2)该合金中镁与铝的物质的量之比。
(3)该合金溶于足量的烧碱溶液中,产生H2的体积(标准状况下)是多少?
查看答案和解析>>
科目:高中化学 来源:2013届甘肃省甘谷一中高三第二次检测考试化学试卷(带解析) 题型:实验题
(12分)(1)下列每组中都有一种物质与其他物质在分类上不同,试分析每组中物质的组成规律,将这种不同于其他物质的物质找出来.
①NaCl、KCl、NaClO、BaCl2 ②浊液、溶液、胶体、水
(2)用98%的浓H2SO4(ρ=1.84 g/cm3)配制500 ml 0.5 mol/L的稀H2SO4,所需浓H2SO4的体积为________ml(小数点后保留一位有效数字),如果实验室有10 ml、20 ml、50 ml量筒,应选用 ml量筒,实验中还需要用到的仪器有 ,若实验中出现下列现象对所配溶液浓度有什么影响?(填偏高、偏低、无影响)
①浓硫酸溶解后未冷却至室温即转移至容量瓶进行定容________②定容时仰视刻度线
③量取好浓硫酸倒入烧杯溶解后,用水洗涤量筒2-3次,将洗涤液倒入烧杯
(3)7.8g的镁铝合金与足量的稀盐酸反应,生成氢气的体积为8.96L(标准状况),则此反应中转移电子的个数为________________,由镁和铝分别产生的氢气的体积之比为________________
(4)取100ml的Na2CO3和Na2SO4的混合溶液与过量盐酸反应,生成0.896L(标况)CO2;若向原混合溶液中加入足量的Ba(OH)2溶液,得到沉淀的质量为10.21g,试计算混合溶液中Na2CO3的物质的量浓度是___________mol/L, Na2SO4的物质的量浓度是___________mol/L。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年甘肃省高三第二次检测考试化学试卷(解析版) 题型:实验题
(12分)(1)下列每组中都有一种物质与其他物质在分类上不同,试分析每组中物质的组成规律,将这种不同于其他物质的物质找出来.
①NaCl、KCl、NaClO、BaCl2 ②浊液、溶液、胶体、水
(2)用98%的浓H2SO4(ρ=1.84 g/cm3)配制500 ml 0.5 mol/L的稀H2SO4,所需浓H2SO4的体积为________ml(小数点后保留一位有效数字),如果实验室有10 ml、20 ml、50 ml量筒,应选用 ml量筒,实验中还需要用到的仪器有 ,若实验中出现下列现象对所配溶液浓度有什么影响?(填偏高、偏低、无影响)
①浓硫酸溶解后未冷却至室温即转移至容量瓶进行定容________②定容时仰视刻度线
③量取好浓硫酸倒入烧杯溶解后,用水洗涤量筒2-3次,将洗涤液倒入烧杯
(3)7.8g的镁铝合金与足量的稀盐酸反应,生成氢气的体积为8.96L(标准状况),则此反应中转移电子的个数为________________,由镁和铝分别产生的氢气的体积之比为________________
(4)取100ml的Na2CO3和Na2SO4的混合溶液与过量盐酸反应,生成0.896L(标况)CO2;若向原混合溶液中加入足量的Ba(OH)2溶液,得到沉淀的质量为10.21g,试计算混合溶液中Na2CO3的物质的量浓度是___________ mol/L, Na2SO4的物质的量浓度是___________ mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com