
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol•L-1 | V(Na2S2O3)/mL | c(H2SO4)/mol•L-1 | V(H2SO4)/mL | V(H2O)/mL |
| ① | 25 | 0.1 | 5.0 | 0.1 | 10.0 | a |
| ② | 25 | 0.1 | 10.0 | 0.1 | 10.0 | 0 |
| ③ | 25 | 0.2 | 5.0 | 0.1 | 5.0 | b |
| ④ | 50 | 0.2 | 5.0 | 0.1 | 10.0 | 5.0 |
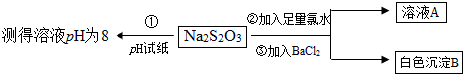
分析 (1)探究温度对速率的影响时,其他条件要保持不变,使温度成为唯一变量,实验①、实验②和实验③的温度相同,浓度不同,反应物的浓度为变量,注意溶液总体积应相同;
(2)Na2S2O3属于强碱弱酸盐,水解显碱性,PH=8在标准比色卡对应的颜色为绿色;氯水具有强氧化性的溶液,白色沉淀B为硫酸钡.
解答 解:(1)其他条件不变探究温度对化学反应速率的影响时,要让浓度保持一致,温度成为唯一变量,②④这两组所取反应物的物质的量是相同的,溶液的总体积也相同,浓度一致,因此可选②④,实验①、实验②和实验③的温度相同,探究Na2S2O3浓度和H2SO4的浓度对化学反应速率的影响,其他条件一致,溶液总体积保持一样,根据②可知溶液总体积为20.0mL,所以a=20.0mL-5.0mL-15.0mL=5.0mL,
b=20.0mL-5.0mL-5.0mL=10.0mL,
故答案为:②④;5.0; 10.0;
(2)PH=8对应标准比色卡对应的颜色为绿色;白色沉淀B为硫酸钡,加入氯水的目的是把S2O32-氧化为硫酸根离子,表现了Na2S2O3的还原性,
故答案为:D;还原.
点评 本题考查外界条件对化学反应速率的影响,探究单一条件对速率的影响时,要让此条件成为唯一变量,注意PH试纸的颜色,整体难度适中.


科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se互为同素异形体 | |
| B. | ${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se互为同位素 | |
| C. | ${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se物理性质和化学性质均相同 | |
| D. | ${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se都含有34个中子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在熔融电解质中,O2-由负极移向正极 | |
| B. | 通入空气的一极是正极,电极反应为:O2+2H2O+4e-═4OH- | |
| C. | 通入甲烷的一极是负极,电极反应为:CH4+8e-+4O2-═CO2+2H2O | |
| D. | 当电路中通过amol电子时,理论上能生成标准状况下CO2气体2.8aL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
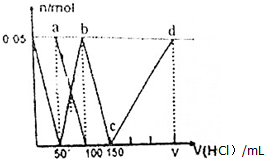
| A. | a点溶液中:c(HCO${\;}_{3}^{-}$)+c(H2CO3)+c(H+)=c(OH-) | |
| B. | 当向混合液中滴加75nL盐酸时,溶液中部分离子浓度大小顺序为:c(Na+)>c(Cl-)>c(CO${\;}_{3}^{2-}$)>c(OH-)>c(H+) | |
| C. | b点溶液中:c(Cl-)+c(HCO3-)+c(H2CO3)+c(CO${\;}_{3}^{2-}$)=1.5mol•L-1 | |
| D. | c→d的过程中水的电离程度逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag | B. | Zn(OH)2 | C. | Ag2O | D. | Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
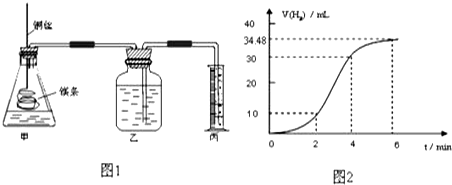
| 实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 10%H2O2的体积/mL | 5.0 | 5.0 | V1 | V2 |
| 20%硫酸的体积/mL | 0 | 0.5 | 1.0 | V3 |
| 水的体积/mL | 15 | 14.5 | V4 | 13.5 |
| 所需时间t/s | t1 | t2 | t3 | t4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成的SO3中 | B. | O2和SO3中 | C. | 剩余的SO3中 | D. | O2、SO2和SO3中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
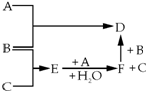 有A、B、C三种常见单质,其有关反应如图所示:已知B、E的水溶液显酸性,E在一定条件下有还原性,但不能被浓H2SO4氧化,B显黄绿色,D遇KSCN溶液显血 红色.
有A、B、C三种常见单质,其有关反应如图所示:已知B、E的水溶液显酸性,E在一定条件下有还原性,但不能被浓H2SO4氧化,B显黄绿色,D遇KSCN溶液显血 红色. ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com