
ij�����ξ���KxFey(C2O4)z?wH2O����Ϊ+3�ۣ������Ϊ-2�ۣ���֪x+y+z=7��ȡ�þ�����������ʵ�飺
�� ȡ4��910g�����ڲ�ͬ�¶��¼��������أ����ù���Ļ�ѧʽ���������±���
| | 120�� | 300�� | 480�� |
| ��ѧʽ | KxFey(C2O4)z | KxFeyO(C2O4)z-1 | KxFeyO2(C2O4)z-2 |
| ���� | 4��370g | 3��650g | 2��930 g |
��1��11��0%��0��110��3�֣�
��2��C2O3��3�֣�
��3��491 ��3�֣�
��4��K3Fe(C2O4)3?3H2O ��7�֣�
���������������1�������ξ����нᾧˮ����������Ϊ����4��910-4��370��*100%/4��910=11%
��2��300�� KxFeyO(C2O4)z-1 ��480�� KxFeyO2(C2O4)z-2 R��C2O3
��3��120�� 4��370g KxFey(C2O4)z �� 300�� 3��650g KxFeyO(C2O4)z-1
�⣺��KxFey(C2O4)z?wH2O�����ʵ���Ϊn
KxFey(C2O4)z?wH2O��KxFey(C2O4)z��KxFeyO(C2O4)z-1��C2O3
1 1 72
n 4��370-3��650
n=0��01
M=m/n=4��910/0��01="491" (g/mol)
��4��2 KxFey(C2O4)z?wH2O��2KxFey(C2O4)z��2wH2O---------��yFe2O3
2 2 36w y
0��01 4��910-4��370=0��54 0��8/160
y=1 w=3 ����Ϊx+y+z=7��
2KxFey(C2O4)z?wH2O��yFe2O3��2wH2O ��Ϊ+3�ۣ������Ϊ-2�ۣ���֪x+y+z=7��
x+3y=2z y=1 ���� x+3=2z x+1+ z=7 x=3 z=3
��ѧʽ��K3Fe(C2O4)3?3H2O
���㣺������ʵ��Ϊ���������黯ѧ�����֪ʶ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��1������ר����Ϊ����������ˮ�е�NO3�� ת��ΪN2���Ӷ������Ⱦ���÷�Ӧ���漰�������У�H2O��Al��OH����Al��OH��3��NO3����N2���뽫�����ӷֱ��������¿ո��뽫��������ʽ��ƽ��д�ڴ���ֽ�ϣ���
NO3��+�� ��+�� ������ +�� ��+�� ���� �÷�Ӧ�����У��������뱻��ԭ��Ԫ�ص����ʵ���֮��Ϊ�� ����
��2����4Al��s��+3O2��g��=2Al2O3��s����H=��a KJ/mol
Fe2O3��s��+C��s��=CO2��g��+2Fe ��s����H="+b" KJ/mol
C��s��+O2��g��=CO2��g����H=��c KJ/mol
д��Al���������������ȷ�Ӧ���Ȼ�ѧ����ʽ���� ����
��3����һ�������������Ͻ�����ˮ�У��Ͻ�ȫ���ܽ⣬�õ�20mL PH=14����Һ��Ȼ����2mol/L������ζ����ɵõ������������ĵ����������ϵ��ͼ����Ӧ�����в��������������Ϊ�� ��L����״����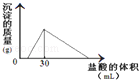
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(1)��ͬ���ʵ�����O2��O3������������Ŀ֮��Ϊ_______,������ԭ�ӵ����ʵ���֮��Ϊ_________��
(2)�ڱ�״���£���4 g H2����11.2 L O2����1 mol H2O�У���ԭ����������_ ___�������С����_______��������ţ�
(3)����£���224L��HCl��������835ml����=1g/cm3����ˮ�У�����������ܶ�Ϊ1.2g/cm3�� ����������ʵ���Ũ��___________.��
(4)ij������������Ϊ6.4 g������6.02��1022�����ӣ�����������Է�������Ϊ_______��
(5)Na2CO3��Ħ��������____________��0.5mol Na2CO3��������____________������________mol Na+��Na+�ĸ���ԼΪ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ij���������ʵ���о�ʱ��������Ũ�Ⱦ�Ϊ1.0mol?L-1 ��Ba(OH)2��H2SO4��Һ��
��.����ͬѧ������Ba(OH)2��Һʱ��ֻ�ҵ��ڿ����б�¶�Ѿõ�Ba(OH)2��8H2O�Լ�����Է���������315����������ȡ�Լ���ˮ�н������ܽ⣬�ձ��д��ڴ���δ���
��1���û�ѧ����ʽ����δ���������ԭ��
��2��ijͬѧ���Ba(OH)2��8H2O��283K��293K��303Kʱ���ܽ�ȣ�g/100g H2O���ֱ�Ϊ2.5��3.9��5.6���ݴ���Ϊ����ʹ�ô�����Ba(OH)2��8H2O����������Ҳ�������1.0 mol?L-1Ba(OH)2��Һ���������ǣ�
��.��18 mol?L-1��Ũ��������450 mL 1.0 mol?L-1ϡ���ᡣ
(3)ʵ��ʱ������ȡŨ��������Ϊ mL�����õ���Ҫ��������Ͳ���ձ����������� ��
(4)������Һʱ�����ݵIJ��������ǣ�
(5)ʵ�������������ʹ������ҺŨ��ƫ�ߵ���
| A��ϴ����ȡŨ�������Ͳ2��3�Σ�����ϴ��Һת������ƿ�� |
| B������ʱ���ӿ̶��� |
| C����ҡ�Ⱥ������¼�ˮ���̶��� |
| D����ˮϴ������ƿδ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��״���£�һ���ˮ���ܽ�700����������õ��ܶ�Ϊ0.9g/mL�İ�ˮ������˰�ˮ�����ʵ���Ũ��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��״���£�1���ˮ�����ܽ�500�����HCl���塣����1 Lˮ��ͨ���״���µ�448LHCl���壬����������ȫ�ܽ⡣
��1����������Һ�ܶ�Ϊ1.2 g/cm3������Һ�к�HCl���ʵ���Ũ��Ϊ ��
��2���Ӹ���Һ��ȡ��10mLŨ�����ܽ���ˮ���Ƴ�500mL��Һ�����ƺ��ϡ��Һ�к�HCl���ʵ���Ũ��Ϊ ��
��3������Ũ������������ϡ����ʱ�����������У�ʹ��ǰ�������Ƿ�©Һ�������� �����ƹ����У����Ũ��ƫ�͵IJ���������_______________��ѡ�����в�������ţ���
| A������ƿ����ˮϴ��δ�Ӹ��� |
| B����Ͳ������ˮϴ��δ���� |
| C�����ձ���Ũ������������ƿ��δ��ˮϴ���ձ������������м�ˮ���̶� |
| D���ý�ͷ�ι�������ƿ�м�ˮʱ�����������̶��ߣ������⽺ͷ�ιܴ�ƿ������������Һʹʣ����Һ���ɴ�̶��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(1)0.7 mol H2O������Ϊ____________�����к���_________��ˮ���ӣ���ԭ�ӵ����ʵ���Ϊ__________��
(2)������ͬ��H2��NH3��SO2��O3���������У����з�����Ŀ���ٵ���_________������ͬ�¶Ⱥ���ͬѹǿ�����£����������___________��
(3)��_______mL 0.2 mo1��L-1 NaOH��Һ(�ܶ�Ϊ1 g��cm-3)�к�1g���ʣ�����50mL0.2 mo1��L-1 CuSO4��Һ����ҪCuSO4��5H2O__________g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
����250ml 1��0 mol/L ��Na2CO3��Һ�����ȡNa2CO3������ٿ�?ȡ���ƺõ���Һ25ml,��������εμ�1��0 mol/L��H2SO4��Һ15ml,�����ɵ������ڱ�״���µ�����Ƕ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
������п����100mL��������Һ�з�Ӧ,���ɱ�״���µ�H24��48L���ش�
��1��������Һ�����ʵ���Ũ�ȡ�
��2��ȡ��������Һ10mL����ˮϡ����100mL����ϡ�ͺ�������Һ�����ʵ���Ũ�ȡ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com