
【题目】反应CH3OH(l)+NH3( g )═CH3NH2(g)+H2O ( g )在某温度自发向右进行,若反应|△H|=17kJ/mol,|△H﹣T△S|=17kJ/mol,对于该反应下列关系正确的是( )
A.△H>0,△H﹣T△S<0
B.△H<0,△H﹣T△S>0
C.△H>0,△H﹣T△S>0
D.△H<0,△H﹣T△S<0
 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
【题目】I.在容器为1L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),且温度升高,混合气体的颜色加深。100℃时,体系中各物质的浓度随时间的变化如图15所示。回答下列问题:
2NO2(g),且温度升高,混合气体的颜色加深。100℃时,体系中各物质的浓度随时间的变化如图15所示。回答下列问题:

(1)100℃时,在0~60s时段,反应速率v(N2O4)为______mol/(L·s),反应的平衡常数K为_______。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020mol/(L·s)平均速率降低,经10s又达到平衡.T_____100℃(填“大于”或“小于”),判断理由是_________。
II.利用LiOH和钴氧化物可制备锂离子电池。正极材料LiOH可由电解法制备,钴氧化物可通过处理钴渣获得。
(1)利用如图16所示的装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。B极区电解液为_____溶液(填化学式),阳极电极反应式为__________________。

(2)利用钴渣[含Co(OH)3、Fe(OH)3等]制备钻氧化物的艺流程如图17:

Co(OH)3在酸溶并发生氧化还原反应时的离子方程式为______________________。在空气中煅烧CoC2O4生成钴的氧化物和CO2,测得充分煅烧后固体的质量为2.73g,CO2的体积为1.344L(标准状况),则钴氧化物的化学式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见元素X、Y、Z 组成的四种物质甲、乙、丙、丁,它们之间能发生反应:甲+乙→丙+丁,其中甲是由X 元素和Z 元素组成的化合物,乙是由Y 元素和Z 元素组成的化合物,丙只含Z 元素。
(1)若甲为淡黄色固体,乙和丙均为常温下的无色无味气体。则甲的电子式为__________;上述反应在标准状况下生成 5.6L 丙时,转移的电子数为__________; 常温下丁溶液pH_____7(填“>”、“<”或“=”),用离子方程式解释_________________________________。
(2)若丙是淡黄色固体,不溶于水也不和水反应。则上述反应的化学方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式为  ,该有机化合物属于( )
,该有机化合物属于( )
①芳香烃 ②芳香族化合物 ③醇④羧酸 ⑤酯 ⑥醛 ⑦烃的衍生物⑧不饱和有机物⑨多官能团有机物.
A.②③④
B.①③⑤⑥
C.①③④⑤⑥⑦
D.②③④⑥⑦⑧⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“纳米材料”是当今材料科学研究的前沿,其研究成果广泛应用于催化及军事科学中。所谓“纳米材料”是指研究、开发出的直径从几纳米至几十纳米的材料,如将纳米材料分散到分散剂中,所得混合物可能具有的性质是( )
A. 不能全部透过滤纸 B. 有丁达尔效应
C. 所得液体呈胶状 D. 所得物质一定是悬浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的位置如右图,其中只有M为金属元素。下列说法不正确的是

A. 原子半径Z<M
B. Y的最离价氧化物对应水化物的酸性比X 的弱
C. X 的最简单气态氢化物的热稳定性比Z的小
D. Z位于元索周期表中第2 周期、第ⅥA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应2NH3![]() N2+3H2在三种不同条件下进行,N2、H2的起始浓度均为0,反应物NH3的浓度(mol/L)随时间(min)的变化情况如下表所示。
N2+3H2在三种不同条件下进行,N2、H2的起始浓度均为0,反应物NH3的浓度(mol/L)随时间(min)的变化情况如下表所示。
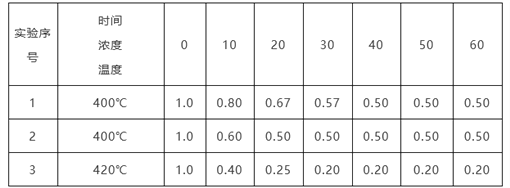
根据上述数据,回答下列问题:
(1)在实验1、2中,有一个实验使用了催化剂,它是______(填字母)。
A.实验1 B.实验2
(2)在实验3中,平衡时NH3的转化率为__________________。
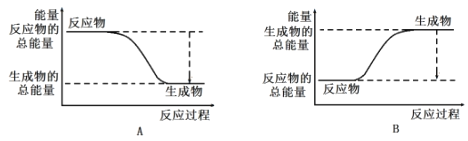
(3)工业合成氨的反应如下:N2+3H2![]() 2NH3。已知断裂1molN2中的共价键吸收的能量为946kJ,断裂1molH2中的共价键吸收的能量为436kJ,形成1molNH3中的共价键放出的能量为1173kJ,则由N2和H2生成2molNH3过程中的能量变化为_______kJ。下图能正确表示该反应中能量变化的是______(填字母)。
2NH3。已知断裂1molN2中的共价键吸收的能量为946kJ,断裂1molH2中的共价键吸收的能量为436kJ,形成1molNH3中的共价键放出的能量为1173kJ,则由N2和H2生成2molNH3过程中的能量变化为_______kJ。下图能正确表示该反应中能量变化的是______(填字母)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com