
| 元素 | 结构或性质信息 |
| T | 原子的L层上s电子数等于p电子数. |
| X | 元素的原子半径是第三周期主族元素中最大的. |
| Y | 空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的. |
| Z | 单质常温常压下是气体.原子的M层上有1个未成对的p电子. |
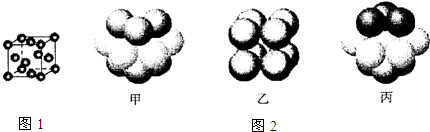
分析 T、X、Y、Z是中学化学常见的四种元素,T原子的L层上s电子数等于p电子数,则T原子外围电子排布为2s22p2,故T为碳元素;X元素的原子半径是第三周期主族元素中最大,则X为Na元素;空气中含Y单质,原子的最外层未成对电子数是该元素所在周期中最多的,则Y为氮元素;Z原子的M层上有1个未成对的p电子,外围电子排布为3s23p1或3s23p5,其单质常温、常压下是气体,故Z为Cl元素,据此解答.
解答 解:T、X、Y、Z是中学化学常见的四种元素,T原子的L层上s电子数等于p电子数,则T原子外围电子排布为2s22p2,故T为碳元素;X元素的原子半径是第三周期主族元素中最大,则X为Na元素;空气中含Y单质,原子的最外层未成对电子数是该元素所在周期中最多的,则Y为氮元素;Z原子的M层上有1个未成对的p电子,外围电子排布为3s23p1或3s23p5,其单质常温、常压下是气体,故Z为Cl元素,
(1)与N2互为等电子体的物质为CO等,故答案为:CO;
(2)NH3分子间能形成氢键,而HCl分子间没有氢键,故NH3的沸点故HCl的沸点,故答案为:NH3分子间能形成氢键,而HCl分子间没有氢键;
(3)非金属性越强,电负性越大,故电负性N>C>Na,故答案为:N>C>Na;
(4)元素Q的原子序数是Na与Cl的原子序数之和,则Q的原子序数为11+17=28,则Q为Ni元素;
①Ni元素原子的核外电子排布式为1s22s22p63s23p63d84s2,其最外层电子排布为3d84s2,故答案为:3d84s2;
②平面型的[Ni(CN)4]2-和四面体的[NiCl4]2-,CN-中C原子价层电子数为1+$\frac{4+1-3}{2}$=2,N原子采取sp杂化,[NiCl4]2-是四面体结构,Ni原子采取sp3杂化,
故答案为:sp;sp3;
③由图可知,Ni的晶体为面心立方堆积,即为“ABC”结构,原子堆积方式是为丙,故答案为:丙.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、等电子体、电负性、氢键、杂化方式判断、晶胞计算等,(4)中注意对晶胞结构的理解.


 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:推断题
 ;
; ;
; ;
;查看答案和解析>>
科目:高中化学 来源:2017届江苏省如皋市高三上学期质量调研一化学试卷(解析版) 题型:填空题
将不可再生的天然气、石油、煤等化石燃料转化利用、变废为宝已成为当务之急。
(1)根据键能数据估算CH4+4F2=CF4+4HF的反应热ΔH= 。
化学键 | C—H | C—F | H—F | F—F |
键能/(kJ·mol-1) | 414 | 489 | 565 | 155 |
(2)甲醇、二甲醚(CH3OCH3)被称为21世纪的新型燃料,均可利用CO和H2反应合成。
①某燃料电池以二甲醚为原料,熔融碳酸盐为电解质,其负极反应如下:
CH3OCH3+6CO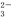 -12e-=8CO2+3H2O。写出该燃料电池的正极反应式: 。
-12e-=8CO2+3H2O。写出该燃料电池的正极反应式: 。
②废水中含甲醇对水质会造成污染,Co3+可将甲醇氧化为CO2。某同学以Pt作电极电解酸性含甲醇废水与CoSO4混合液模拟工业除污原理,其阳极反应式为 。
(3)某企业采用如图所示原理处理化石燃料开采、加工过程产生的H2S废气。
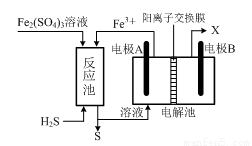
①电解池中电极A、B均为惰性电极,其中A为电解池的 极;电极B所得到的物质X的分子式为 。
②反应池中发生的离子反应方程式为 。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省如皋市高三上学期质量调研一化学试卷(解析版) 题型:选择题
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子最外层比次外层多3个电子;Y、Z均为金属,Y是同周期中原子半径最大的元素,Z的简单离子半径在同周期元素中最小;W的最高价氧化物在无机含氧酸中酸性最强。下列说法正确的是
A. X的气态氢化物的热稳定性比O(氧)的强
B. 元素Z、W的简单离子具有相同的电子层结构
C. Y、Z、W的最高价氧化物对应的水化物之间能相互反应
D. 等质量的Y和Z单质分别与足量稀盐酸反应,前者产生的氢气多
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
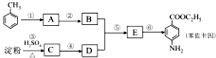 甲苯是一种重要的化工原料,可以参与合成很多物质.如图为以甲苯为原料得到药物苯佐卡因的合成路线.
甲苯是一种重要的化工原料,可以参与合成很多物质.如图为以甲苯为原料得到药物苯佐卡因的合成路线.
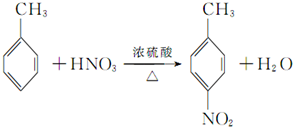 ,该反应要控制好低温条件,否则会生成一种新物质F,该物质是一种烈性炸药,F的名称为2,4,6-三硝基甲苯.
,该反应要控制好低温条件,否则会生成一种新物质F,该物质是一种烈性炸药,F的名称为2,4,6-三硝基甲苯.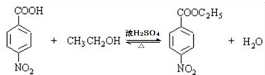 .
. .
.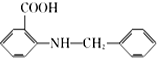 是一种药物中间体,请写出以甲苯为主要原料制备该中间体的合成路线流程图:
是一种药物中间体,请写出以甲苯为主要原料制备该中间体的合成路线流程图: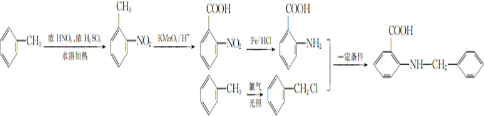 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 保存FeCl3溶液时,可加入少量NaOH,抑制Fe3+水解 | |
| B. | 1molMg在空气中完全燃烧生成MgO和少量Mg3N2,转移的电子数为2NA | |
| C. | 加入铝粉能产生H2的溶液中可以大量存在Fe2+、Na+、SO42-、ClO-四种离子 | |
| D. | 向硫酸氢铵溶液中滴加少量NaOH溶液时发生反应的离子方程式:H++NH4++20H-═NH3•HzO+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物.
A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8.15 | B. | 9.3 | C. | 10.15 | D. | 11.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com