
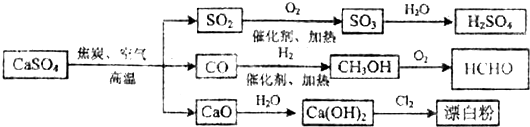
| A. | 除去与水反应外,图示中其它的转化反应均为氧化还原反应 | |
| B. | CO、SO2、SO3 均是酸性氧化物 | |
| C. | 工业上利用Cl2和澄清石灰水反应来制取漂白粉 | |
| D. | 用CO合成CH3OH 进而合成HCHO的两步反应,原子利用率均为100% |
分析 A.凡是有化合价升降的反应都是氧化还原反应;
B.酸性氧化物是一类能与水作用生成酸或与碱作用生成盐和水或与碱性氧化物反应生成盐的氧化物;
C.工业上常用氯气和消石灰反应来制取漂白粉;
D.原子利用率是指反应物中的所有原子进入期望产物中的百分比.
解答 解:A.除去与水反应,图示转化反应都是与氧气反应或氢气反应,都一定有化合价升降,均为氧化还原反应,故A正确;
B.CO不能与碱反应,不是酸性氧化物,故B错误;
C.澄清石灰水中氢氧化钙的浓度较小,应用纯净的消石灰,故C错误;
D.工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)?CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
反应Ⅱ中不是所有原子进入期望产物,原子利用率不为100%,故D错误.
故选A.
点评 本题考查酸性氧化物、氧化还原反应、漂白粉的制取、原子利用率,难度不大,注意澄清石灰水中氢氧化钙的浓度较小,应用纯净的消石灰制取漂白粉.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
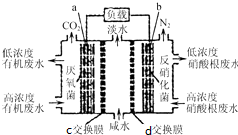 一种三室微生物燃料电池(MFC)污水净化系统原理如图所示,图中废水有机物可用C6H10O5表示.有关说法不正确的是( )
一种三室微生物燃料电池(MFC)污水净化系统原理如图所示,图中废水有机物可用C6H10O5表示.有关说法不正确的是( )| A. | 电子从a极经负载到b极 | |
| B. | c为氯离子交换膜,d为钠离子交换膜,中间室可用作海水淡化 | |
| C. | 负极反应式:C6H10O5-24e-+7H2O═6CO2↑+24H+ | |
| D. | 反应后将左右两室溶液混合较反应前两室溶液混合的酸性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.10mol•L-1NH4HCO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-) | |
| B. | 向0.10mol•L-1NaHSO3溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32-) | |
| C. | 向0.10mol•L-1Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)] | |
| D. | 向0.10mol•L-1CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用图1所示装置制取氨气 | |
| B. | 用图2所示装置量取20.0ml的H2SO4待测液放入锥形瓶中 | |
| C. | 用图3所示装置用CaC2和饱和食盐水反应制取C2H2 | |
| D. | 用图4所示装置可证明乙醇发生消去反应生成了乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
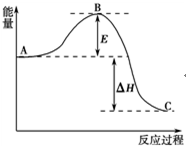 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题:
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂能改变反应限度 | |
| B. | 升高温度,则反应速率减慢 | |
| C. | 四种物质的量浓度相等时,则一定达到了该反应的限度 | |
| D. | 各物质的浓度不再发生变化时,则达到化学反应的限度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com