
某反应4A(g)+5B(g)=4C(g)+6D(g),在四种不同情况下的反应速率分别为:①υ(A)=0.4mol/(L·s);
②υ(B)=0.6mol/(L·s);③υ(C)="0.45mol/(L·s)" ;④υ(D)=0.9mol/(L·s)。该反应进行得最快的是 ( )
A.① B.②③ C.①④ D.④
科目:高中化学 来源: 题型:
 2Z(g)达到平衡时,各物质的平衡浓度为c(X)=0.5mol/L;c(Y)=0.1mol/L; c (Z)=1.6mol/L若用a、b、c 分别表示X Y Z的初始浓度(mol/L)则a、b应满足的关系是
2Z(g)达到平衡时,各物质的平衡浓度为c(X)=0.5mol/L;c(Y)=0.1mol/L; c (Z)=1.6mol/L若用a、b、c 分别表示X Y Z的初始浓度(mol/L)则a、b应满足的关系是 dD(g)+eE(g),建立平衡后,维持温度不变而压强改变,测得D的浓度变化如下:
dD(g)+eE(g),建立平衡后,维持温度不变而压强改变,测得D的浓度变化如下:| 压强(Pa) | 4×105 | 6×105 | 10×105 | 20×105 |
| D的浓度(mol/L) | 0.085 | 0.126 | 0.200 | 0.440 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 4 |
| a2 |
| 4 |
| a2 |
| △ |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)常温下,X、Y的水溶液的pH均为5,则两种水溶液中由水电离出的H+浓度之比是__________。
(2)A、B、D、E四种元素组成的某无机化合物,受热易分解。写出少量该化合物溶液与足量的Ba(OH)2溶液反应的离子方程式_______________________________________。
(3)将铝片和镁片用导线相连,插入由A、D、E三种元素组成物质的稀溶液中构成原电池,则负极的电极反应式为_______________________________________。
(4)化学反应![]() 2CA3(g)。
2CA3(g)。
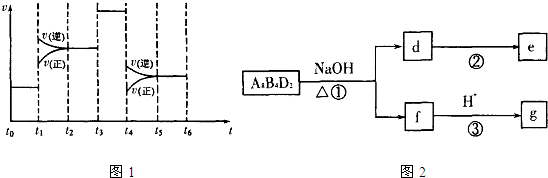
当反应达到平衡时不断改变条件(不改变A2、C2和CA3的量),下图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是________________________。温度为T ℃时,将

(5)化合物A8B4D2有如下转化关系:

其中,g是常用调味品的主要成分。写出反应①的化学方程式__________________________。
设计实验方案完成d→e的转化____________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河北省邯郸市高三教学质量检测理综化学试卷(解析版) 题型:填空题
工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:
CO(g)+2H2(g) CH3OH(g) ΔH
CH3OH(g) ΔH
(1)根据图1请写出合成甲醇的热化学方程式
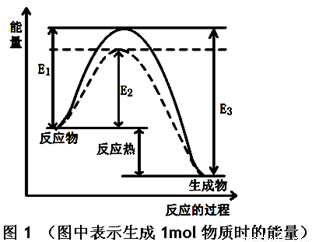
(热量用E1、E2或E3表示)。
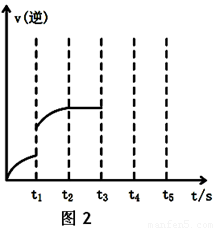
(2)该反应的逆反应速率随时间变化的关系如上图2。t1时改变了某种条件,改变的条件可能是 。
(3)判断反应达到平衡状态的依据是 (填字母序号,下同)。
A. 2v(H2)(逆) =v(CO)(正)
B. 混合气体的密度不变
C. 混合气体的平均相对分子质量不变
D. CH3OH、CO、H2的浓度都不再发生变化
E.容器内CO、H2、CH3OH的浓度之比为1:2:1
(4)在一定温度下,若将4a mol H2和2amol CO放入2L的密闭容器中,充分反应后测得CO的转化率为50%,则该反应的平衡常数为 。若此时再向该容器中投入a mol CO、2amol H2和amol CH3OH,判断平衡移动的方向是 (“正向移动”“逆向移动”或“不移动”);与原平衡相比,CO的物质的量浓度 (填“增大”、“不变”或“减小”)。
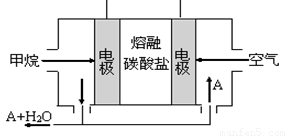
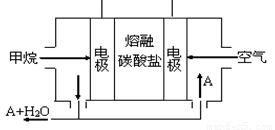
(5)某甲烷燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料做电极。为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见右图)。A物质的化学式是_________;该原电池的负极反应式可表示为 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年甘肃省河西五市高三第一次联合考试化学试卷(解析版) 题型:填空题
工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:
CO(g)+2H2(g) CH3OH(g) ΔH
CH3OH(g) ΔH
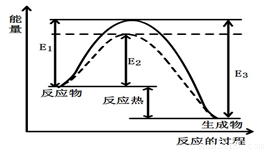
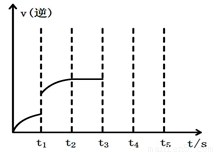
图1 (图中表示生成1mol物质时的能量) 图2
(1)根据图1请写出合成甲醇的热化学方程式
(2)该反应的逆反应速率随时间变化的关系如上图2。t1时改变了某种条件,改变的条件可能是 。
(3)判断反应达到平衡状态的依据是 (填字母序号)。
A.2v(H2)(逆) =v(CO)(正) B.混合气体的密度不变
C.混合气体的平均相对分子质量不变 D.CH3OH、CO、H2的浓度都不再发生变化
E.容器内CO、H2、CH3OH的浓度之比为1:2:1
(4)在一定温度下,若将4a mol H2和2amol CO放入2L的密闭容器中,充分反应后测得CO的转化率为50%,则该反应的平衡常数为 。若此时再向该容器中投入a mol CO、2amol H2和amol CH3OH,判断平衡移动的方向是 (“正向移动”“逆向移动”或“不移动”);与原平衡相比,CO的物质的量浓度 (填“增大”、“不变”或“减小”)。
(5)某甲烷燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料做电极。为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见图)。A物质的化学式是_________;该原电池的负极反应式可表示为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com