
| A£® | Ć÷·Æ¾»Ė®£ŗAl3++3H2O=Al£ØOH£©3”ż+3H+ | |
| B£® | ÓĆ¹żĮæ°±Ė®ĪüŹÕ¹¤ŅµĪ²ĘųÖŠµÄSO2£ŗ2NH3•H2O+SO2=2NH4++SO32-+H2O | |
| C£® | ÓĆCuCl2ČÜŅŗ×öµ¼µēŹµŃ飬µĘÅŻ·¢¹ā£ŗCuCl2$\frac{\underline{\;Ķصē\;}}{\;}$Cu2++2C1- | |
| D£® | ÓĆøßĆĢĖį¼Ų±ź×¼ČÜŅŗµĪ¶Ø²ŻĖį£ŗ2MnO4-+16H++5C2O42-=2Mn2++10CO2”ü+8H2O |
·ÖĪö A£®Ė®½āĪŖæÉÄę·“Ó¦£¬ĒŅ²»Éś³É³Įµķ£»
B£®·“Ӧɜ³ÉŃĒĮņĖįļ§”¢Ė®£»
C£®·¢ÉśµēĄė£¬²»ŹĒµē½ā£»
D£®²ŻĖįŌŚĄė×Ó·“Ó¦ÖŠ±£Įō»ÆѧŹ½£®
½ā“š ½ā£ŗA£®Ć÷·Æ¾»Ė®µÄĄė×Ó·“Ó¦ĪŖAl3++3H2O?Al£ØOH£©3+3H+£¬¹ŹA“ķĪó£»
B£®ÓĆ¹żĮæ°±Ė®ĪüŹÕ¹¤ŅµĪ²ĘųÖŠµÄSO2µÄĄė×Ó·“Ó¦ĪŖ2NH3•H2O+SO2=2NH4++SO32-+H2O£¬¹ŹBÕżČ·£»
C£®ÓĆCuCl2ČÜŅŗ×öµ¼µēŹµŃ飬µĘÅŻ·¢¹ā£¬·¢ÉśCuCl2=Cu2++2C1-£¬¹ŹC“ķĪó£»
D£®ÓĆøßĆĢĖį¼Ų±ź×¼ČÜŅŗµĪ¶Ø²ŻĖįµÄĄė×Ó·“Ó¦ĪŖ2MnO4-+6H++5H2C2O4=2Mn2++10CO2”ü+8H2O£¬¹ŹD“ķĪó£»
¹ŹŃ”B£®
µćĘĄ ±¾Ģāæ¼²éĄė×Ó·“Ó¦·½³ĢŹ½µÄŹéŠ“£¬ĪŖøßĘµæ¼µć£¬°ŃĪÕ·¢ÉśµÄ·“Ó¦¼°Ąė×Ó·“Ó¦µÄŹéŠ“·½·ØĪŖ½ā“šµÄ¹Ų¼ü£¬²ąÖŲ·ÖĪöÓėÓ¦ÓĆÄÜĮ¦µÄ漲飬עŅāĄė×Ó·“Ó¦ÖŠ±£Įō»ÆѧŹ½µÄĪļÖŹ¼°µē×Ó”¢µēŗÉŹŲŗć£¬ĢāÄæÄŃ¶Č²»“ó£®


 ½×ĢŻ¼ĘĖćĻµĮŠ“š°ø
½×ĢŻ¼ĘĖćĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
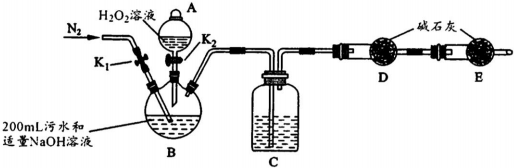
| ²½Öč1 | ¹Ų±ÕK1£¬“ņæŖK2£¬µĪČė×ćĮæH2O2ČÜŅŗ£¬¶ŌB¼ÓČČ£®³ä·Ö·“Ó¦ŗó£¬Ķ£Ö¹¼ÓČČ£® |
| ²½Öč2 | ĄäČ“ŗó£¬ÓĆ×¢ÉäĘ÷“©¹żB×°ÖĆµÄ½ŗČū×¢ČėĻ”H2S04ČÜŅŗ£® |
| ²½Öč3 | “ņæŖK1£¬ĶØČėN2£® |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
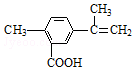
| A£® | ŌŚŅ»¶ØĢõ¼žĻĀ£¬ÄÜ·¢ÉśČ”“ś”¢Ńõ»Æ”¢Ė®½ā”¢õ„»ÆŗĶ¼Ó¾Ū·“Ó¦ | |
| B£® | øĆĪļÖŹ·Ö×ÓÖŠ×ī¶ąæÉŅŌÓŠ9øöĢ¼Ō×ÓŌŚĶ¬Ņ»Ę½ĆęÉĻ | |
| C£® | 1 moløĆĪļÖŹ×ī¶ąæÉÓė5mol H2·¢Éś¼Ó³É·“Ó¦ | |
| D£® | 1 moløĆĪļÖŹĶźČ«Ńõ»Æ×ī¶ąæÉĻūŗÄ13 molŃõĘų |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 1L pH=lµÄĮņĖįČÜŅŗÖŠŗ¬ÓŠµÄH+ŹżÄæĪŖ0.2NA | |
| B£® | 1 molōĒ»łÓėl molĒāŃõøłĄė×ÓĖłŗ¬ÖŹ×ÓŹż¾łĪŖ9NA | |
| C£® | 14 gÓÉN2ÓėCO×é³ÉµÄ»ģŗĻĘųĢåÖŠŗ¬ÓŠµÄŌ×ÓŹżÄæĪŖ2NA | |
| D£® | ±ź×¼×“æöĻĀ£¬2.24 L Cl2ČÜÓŚĖ®£¬×ŖŅʵĵē×ÓŹżÄæĪŖ0.1NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
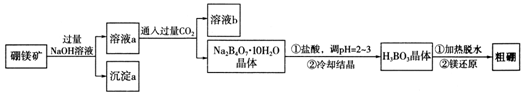

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ė®ŹĒŅ»ÖÖŗÜŗƵÄČܼĮ | B£® | Ė®ŌŚČĖĢåÄŚ»¹ÓŠµ÷½ŚĢåĪĀµÄ×÷ÓĆ | ||
| C£® | ŅūÓĆĖ®Ō½“æ¾»¶ŌÉķĢåŌ½ŗĆ | D£® | Ė®ŹĒ·“Ó¦½éÖŹŗĶ·“Ó¦Īļ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | µē³Ų¹¤×÷Ź±£¬ČÜŅŗÖŠµÄĀĮĄė×ÓĻņÕż¼«ŅĘ¶Æ | |
| B£® | øƵē³ŲæÉÄÜŹĒŅ»ÖÖæɳäµēµÄ¶ž“Īµē³Ų | |
| C£® | ĻūŗÄĻąĶ¬ÖŹĮ潚ŹōŹ±£¬ÓĆļ®×öøŗ¼«Ź±£¬²śÉśµē×ÓµÄĪļÖŹµÄĮæ±ČĀĮ¶ą | |
| D£® | øƵē³Ųøŗ¼«µÄµē¼«·“Ó¦ĪŖ£ŗAl-3e-ØTAl3+ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
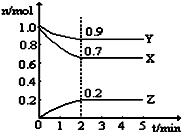 £Ø1£©·“Ó¦3A£Øg£©+B£Øg£©ØT2C£Øg£©ŌŚČżÖÖ²»Ķ¬µÄĢõ¼žĻĀ½ųŠŠ·“Ó¦£¬ŌŚĶ¬Ņ»Ź±¼äÄŚ£¬²āµĆµÄ·“Ó¦ĖŁĀŹÓĆ²»Ķ¬µÄĪļÖŹ±ķŹ¾ĪŖ¢ŁvA=1 mol/£ØL•min£©”¢¢ŚvC=0.5mol/£ØL•min£©”¢¢ŪvB=0.5mol/£ØL•min£©£¬ČżÖÖĒéæöĻĀøĆ·“Ó¦ĖŁĀŹÓɓ󵽊”µÄ¹ŲĻµŹĒ¢Ū£¾¢Ł£¾¢Ś£®£ØÓĆŠņŗűķŹ¾£©
£Ø1£©·“Ó¦3A£Øg£©+B£Øg£©ØT2C£Øg£©ŌŚČżÖÖ²»Ķ¬µÄĢõ¼žĻĀ½ųŠŠ·“Ó¦£¬ŌŚĶ¬Ņ»Ź±¼äÄŚ£¬²āµĆµÄ·“Ó¦ĖŁĀŹÓĆ²»Ķ¬µÄĪļÖŹ±ķŹ¾ĪŖ¢ŁvA=1 mol/£ØL•min£©”¢¢ŚvC=0.5mol/£ØL•min£©”¢¢ŪvB=0.5mol/£ØL•min£©£¬ČżÖÖĒéæöĻĀøĆ·“Ó¦ĖŁĀŹÓɓ󵽊”µÄ¹ŲĻµŹĒ¢Ū£¾¢Ł£¾¢Ś£®£ØÓĆŠņŗűķŹ¾£©²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com