
| A. | 同周期元素中,ⅦA族元素的原子半径最大 | |
| B. | ⅥA族元素的原子,其半径越大,越容易得到电子 | |
| C. | 室温时,零族元素的单质都是气体 | |
| D. | 同一周期中,卤族元素的第一电离能最大 |
科目:高中化学 来源: 题型:选择题
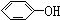 与
与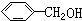
 与
与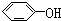
| A. | ④⑤ | B. | ①⑥ | C. | ②③ | D. | ①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
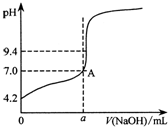 现用邻苯二甲酸氢钾(本题中用KHA表示)标准溶液来测定某NaOH溶液的浓度,进行如下操作:
现用邻苯二甲酸氢钾(本题中用KHA表示)标准溶液来测定某NaOH溶液的浓度,进行如下操作:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
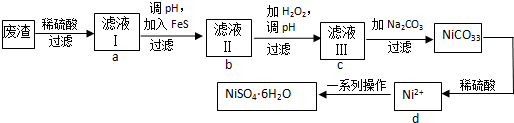
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃烧、酸碱中和反应都是放热反应 | |
| B. | 化学反应必然伴随着能量的变化 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 反应物总能量和生成物总能量的相对大小决定了反应是放出能量还是吸收能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
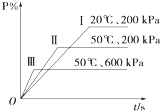 在一密闭容器中进行以下可逆反应:M(g)+P(g)═N(g)+2L.在不同的条件下P的百分含量P%的变化情况如图,则该反应( )
在一密闭容器中进行以下可逆反应:M(g)+P(g)═N(g)+2L.在不同的条件下P的百分含量P%的变化情况如图,则该反应( )| A. | 正反应放热,L是固体 | B. | 正反应吸热,L是气体 | ||
| C. | 正反应吸热,L是固态 | D. | 正反应放热,L是固体或气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2通入品红溶液 | B. | 碘酒滴入淀粉溶液 | ||
| C. | 乙烯通入酸性KMnO4溶液中 | D. | Cl2通入NaOH溶液中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com