
【题目】对于反应![]() 在容积为10L的密闭容器中进行。起始时
在容积为10L的密闭容器中进行。起始时![]() 和
和![]() 均为0.20mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。下列说法不正确的是( )
均为0.20mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。下列说法不正确的是( )
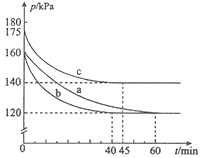
A. 实验c条件下,从反应开始至达到平衡时![]()
B. 实验a条件下,用浓度表示的平衡常数为100
C. 该反应的![]()
D. 比较实验a、c可判断升高温度反应速率加快
【答案】C
【解析】
A. 实验c条件下,实验中60min到达平衡,恒温恒容下,利用压强之比等于物质的量之比计算平衡时混合气体总物质的量,再利用差量法代入公式计算得(0.2+0.2)mol×![]() =0.32mol,0.4mol-0.32mol=0.08mol,所以
=0.32mol,0.4mol-0.32mol=0.08mol,所以![]() ,A项正确;
,A项正确;
B.恒温恒容下,压强之比等于物质的量之比,实验a中平衡时混合气体总物质的量为(0.2+0.2)mol×![]() =0.3mol,这说明平衡时消耗反应物的物质的量和生成的生成物的物质的量均是0.4mol-0.3mol=0.1mol,剩余反应物均是0.2mol-0.1mol=0.1mol,容器容积为10L,则平衡常数K=
=0.3mol,这说明平衡时消耗反应物的物质的量和生成的生成物的物质的量均是0.4mol-0.3mol=0.1mol,剩余反应物均是0.2mol-0.1mol=0.1mol,容器容积为10L,则平衡常数K=![]() =
=![]() =100,B项正确;
=100,B项正确;
C. 根据c和a的反应判断,c起始压强较大,而投料量和容器的体积都没有变化,所以由公式PV=nRT来推断,是温度引起的,即c中温度高于a中温度,根据A和B可知c中反应物转化率低,说明升高温度,反应逆向进行,所以该反应为放热反应,C项错误;
D. 根据以上分析可知c中温度高,反应首先达到平衡状态,所以比较实验a、c可判断升高温度反应速率加快,D项正确;
答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO![]() 2CO2+N2。假设常温下在恒容的密闭容器中发生上述反应,试解答下列问题:
2CO2+N2。假设常温下在恒容的密闭容器中发生上述反应,试解答下列问题:
(1)上述条件下该反应能够自发进行,则反应的ΔH_____0(填写“>”、“<”、“=”)。
(2)能判断该反应达到化学平衡状态的依据是____________。
A.混合气体的压强保持不变
B.N2的浓度不再改变
C.消耗CO的物质的量与生成CO2的物质的量之比为1∶1
D.NO、CO、CO2、N2的物质的量之比为2∶2∶2∶1
(3)既要加快反应速率又要提高NO转化率,下列措施可行的是____________。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(4)为了测定在某种催化剂作用下的反应速率,某科学家在某温度下用气体传感器测得不同时间的NO和CO浓度如表(均不考虑温度变化对催化剂催化效率的影响):
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO) ( molL-1) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
c(CO) ( molL-1) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | X | 2.70×10-3 |
从表中数据分析可知:
①X=____________mol·L-1;
②前2s内的平均反应速率v(N2)=________________________mol·L-1·s-1;
③该温度下反应的平衡常数K=________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列反应中,水既不是氧化剂,又不是还原剂的是
A.2Na+2H2O=2NaOH+H2↑ B.Cl2+H2O=HCl+HClO
C.2F2+2H2O=4HF+O2 D.3Fe+4H2O![]() Fe3O4+4H2↑
Fe3O4+4H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
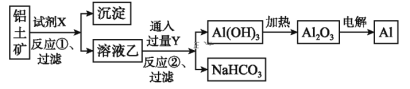
下列叙述正确的是( )
A. 试剂X可以是氢氧化钠溶液,也可以是盐酸
B. 反应①过滤后所得沉淀为氢氧化铁
C. 图中所示转化反应都不是氧化还原反应
D. 反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)K2Cr2O7+14HCl═2KCl+2CrCl3+3Cl2↑+7H2O氧化剂是______,氧化产物与还原产物的物质的量之比为_______。
(2)配平下列反应方程式
①____S +____HNO3——_____H2SO4 +______NO2↑ +____H2O
② 若6.4g单质硫参加反应时,反应过程中转移电子的物质的量为______。
(3)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染,化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气),若反应中消耗Cl2 1.5mol则被氧化的NH3在标准状况下的体积为_____ L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度不变恒容的容器中H2、I2各1mol·L-1进行反应H2+ I2![]() 2HI,若某段时间内H2浓度由0.4mol·L-1降到0.24mol·L-1所需的反应时间为8s ,则反应起始时H2浓度由1mol·L-1降到0.4mol·L-1需的时间为
2HI,若某段时间内H2浓度由0.4mol·L-1降到0.24mol·L-1所需的反应时间为8s ,则反应起始时H2浓度由1mol·L-1降到0.4mol·L-1需的时间为
A. 小于30sB. 等于30sC. 大于30sD. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语表达正确的是
A. NaHS的电离:NaHS = Na+ + H+ + S2-
B. 把金属铁放入稀硝酸中: Fe + 2H+ = Fe2+ + H2↑
C. NaHCO3溶液与少量的澄清石灰水反应:HCO3- + OH- + Ca2+ = CaCO3↓+ H2O
D. HClO的电离:HClO ![]() H+ + ClO-
H+ + ClO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将Mg条放入浓NH4Cl溶液中产生无色气体,该气体是________(填化学式),请用离子方程式解释该现象产生的原因________________。
(2)Mg(OH)2浊液中存在Mg(OH)2的沉淀溶解平衡,可表示为(用离子方程式表示)____________,若向此浊液中加入浓的NH4Cl溶液,观察到的现象是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com