

分析 (1)浓盐酸易挥发,制取的氯气中含有水蒸气和氯化氢,通过C、D装置分别除去氯化氢和水蒸气;
(2)干燥的氯气和铁反应生成棕色烟氯化铁固体颗粒;
(3)A中发生的反应:二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水;
G中发生的反应为:氯气与氢氧化钠反应生成氯化钠和次氯酸钠和水.
解答 解:(1)浓盐酸易挥发,制取的氯气中含有水蒸气和氯化氢,C是饱和食盐水除去氯化氢气体和D是浓硫酸干燥,
故答案为:除氯气中的氯化氢气体;除水蒸气;
(2)干燥的氯气和铁反应生成氯化铁固体颗粒,方程式:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3;
故答案为:FeCl3;
(3)A中发生的反应:二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水,化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
G中发生的反应为:氯气与氢氧化钠反应生成氯化钠和次氯酸钠和水,化学方程式:Cl2+2NaOH=NaCl+NaClO+H2O.
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;Cl2+2NaOH=NaCl+NaClO+H2O.
点评 本题考查了实验室制备氯气的实验过程和除杂分析判断,尾气处理方法,主要是反应离子方程式的书写和氯气性质的分析判断,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温常压下测得1 mol N2的质量为28 g | |
| B. | 用量筒测得排水法收集到的氢气体积为50.28 mL | |
| C. | 用两只250 mL的容量瓶配制0.1 mol/L 500 mL的NaOH溶液 | |
| D. | 用托盘天平称得2.5 g胆矾,受热充分失水后,固体质量减轻0.9 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 2CH3CHO+2H2O
2CH3CHO+2H2O 
 (其中一种)
(其中一种)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L | B. | 0.25mol/L | C. | 1mol/L | D. | 1.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
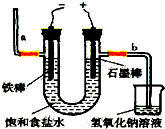 氯气是一种重要的化工原料,自来水消毒、农药的生产、药物的合成等都需要用到氯气.工业上通常采用电解法制氯气:观察如图,回答:
氯气是一种重要的化工原料,自来水消毒、农药的生产、药物的合成等都需要用到氯气.工业上通常采用电解法制氯气:观察如图,回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池是将电能转变为化学能的装置 | |
| B. | 原电池工作时,阳离子向负极方向移动 | |
| C. | 反应Cu+2H+=Cu2++H2↑可设计成原电池装置 | |
| D. | 锌跟稀硫酸反应制取氢气,加入少量硫酸铜溶液能加快反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 温度T/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
| 实验编号 | n(CO)/mol | n(H2O)/mol | n(H2)/mol | n(CO2)/mol |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 0.5 | 2 | 1 | 1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com