
| c(酸)V(酸)-c(碱)V(碱) |
| V(酸)+V(碱) |
| c(酸)V(酸)-c(碱)V(碱) |
| V(酸)+V(碱) |
| 0.01×2-0.001×9 |
| 2+9 |
| c(酸)V(酸)-c(碱)V(碱) |
| V(酸)+V(碱) |


科目:高中化学 来源: 题型:阅读理解
| c(C) |
| c(A)?c(B) |
| c(C) |
| c(A)?c(B) |
| 1 |
| 3 |
| 1 |
| 30 |
| 1 |
| 30 |
查看答案和解析>>
科目:高中化学 来源: 题型:
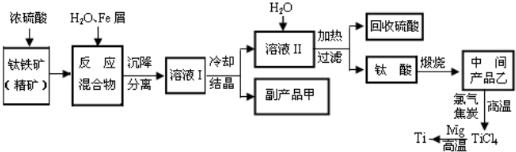
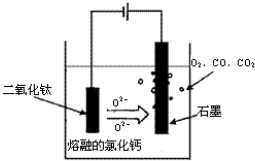
查看答案和解析>>
科目:高中化学 来源:2013届江苏省泰州中学高三上学期期中考试化学试卷(带解析) 题型:填空题
(15分)平衡指的是两个相反方向的变化最后所处的运动状态;在平衡时,两种变化仍在继续进行,但是它们的速率相等;根据变化的性质可分为物理平衡和化学平衡,中学阶段涉及的平衡有气体可逆反应的平衡、酸碱电离平衡、水解平衡及沉淀-溶解平衡等等。
(1)现有容积为1 L的恒温恒容密闭容器,向其中加入2 mol A气体和2 mol B气体后发生如下反应:A(g)+B(g) C(g) △H=" -" a kJ·mol-1,20s后,反应达到平衡状态,生成1 mol C气体,放出热量Q1kJ。回答下列问题。
C(g) △H=" -" a kJ·mol-1,20s后,反应达到平衡状态,生成1 mol C气体,放出热量Q1kJ。回答下列问题。
①计算20s内B气体的平均化学反应速率为___________,写出该反应的平衡常数表达式___________。
②保持容器温度和容积不变,若改为向其中加入1molC气体,反应达到平衡时,吸收热量Q2kJ,则Q1 与Q2的相互关系正确的是____________(填字母)。
(A)Q1 + Q2 = a (B) Q1 + 2Q2 < 2a (C)Q1 + 2Q2 > 2a (D)Q1 + Q2 < a
③在原平衡基础上,保持容器温度和容积不变,向容器中再通入bmolA气体(b>0)时,v(正)_____v(逆)(填“>”、“<”或“=”),重新达平衡后,C气体的平衡体积分数 (C) =
(C) = 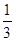 ,则b = ____________。
,则b = ____________。
(2)常温下,将VmL、0.1000mol·L-1氢氧化钠溶液逐滴加入到20.00mL、0.1000mol·L-1醋酸溶液中,充分反应。回答下列问题。(忽略溶液体积的变化)
①如果溶液pH=7,此时V的取值_____20.00(填“>”、“<”或“=”),而溶液中c(Na+)、c(CH3COO-)、c(H+)、c(OH-)的大小关系为_____________________________________________。
②如果V=40.00,则此时溶液中c(OH-) -c(H+) - c(CH3COOH)= ___________________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列酸碱发生中和反应,有关判断正确的是
A.同浓度的NaOH溶液和CH3COOH溶液等体积混合后,
![]()
B.pH=3的CH3COOH溶液和pH=11的KOH溶液等体积混合,
![]()
C.pH=2的HNO3溶液与pH=12的NH3?H2O溶液等体积混合,
![]()
D.pH=2的盐酸与pH=11的NaOH溶液按体积比2:9混合,混合液pH=3.2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com