
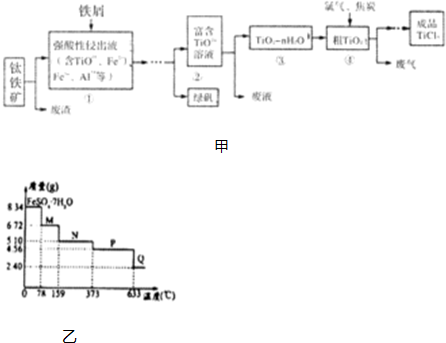
分析 (1)往①中加入铁屑至浸出液显紫色,说明浸出液中含有Ti3+,由方程式可知,Fe3+氧化为Ti3+;控制条件以形成TiO2•n H2O溶胶,说明得到胶体,其分散质颗粒直径大小为10-9~10-7m(或1nm-100nm);
(2)依据平衡常数的概念结合反应写出计算式计算平衡浓度得到;
(3)依据热化学方程式和盖斯定律计算分析得到;
(4)绿色化学应零污染、零排放,原子利用率100%.结合工艺流程三废回答;
(5)8.34g FeS04•7H20样品物质的量=$\frac{8.34g}{278g/mol}$=0.03mol,其中m(H20)=0.03mol×7×18g/mol=3.78g,如晶体全部失去结晶水,固体的质量应为8.34g-3.78g=4.56g,可知在加热到373℃之前,晶体失去部分结晶水,结合质量的变化可确定在不同温度时加热后固体的化学式,加热至633℃时,固体的质量为2.40g,其中n(Fe)=n( FeS04•7H20)=0.03mol,m(Fe)=0.03mol×56g/mol=1.68g,则固体中m(O)=2.40g-1.68g=0.72g,n(O)=$\frac{0.72g}{16g/mol}$=0.045mol,则n(Fe):n(O)=0.03mol:0.045mol=2:3,则固体物质Q的化学式为Fe2O3,以此解答;
(6)充电时的阳极反应阳极发生氧化反应,放电时阳离子向正极移动.
解答 解:(1)往①中加入铁屑至浸出液显紫色,说明浸出液中含有Ti3+,由方程式可知,Fe3+氧化为Ti3+,加入铁屑作还原剂,将Fe3+还原为Fe2+,防止Ti3+被Fe3+氧化成TiO2+,控制条件以形成TiO2•n H2O溶胶,说明得到胶体,其分散质颗粒直径大小为10-9~10-7m(或1nm-100nm),
故答案为:使溶液中的铁离子还原成亚铁离子,生成Ti3+保护亚铁离子不被氧化;1~100;
(2)Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=2.79×10-39,反应Fe (OH)3+3H+?Fe3++H2O的平衡常数K=$\frac{c(F{e}^{3+})}{{c}^{3}({H}^{+})}$=$\frac{c(F{e}^{3+})}{(\frac{1{0}^{-14}}{c(O{H}^{-})})^{3}}$=c(Fe3+)×c3(OH-)×1042=2.79×10-39×1042=2.79×103.
故答案为:2.79×103;
(3)①TiO2 (s)+2Cl2 (g)═TiCl4(l)+O2(g)△H=+140KJ•mol-1
②2C(s)+O2(g)═2CO(g)△H=-221KJ•mol-1
依据盖斯定律①+②得到:TiO2(s)+2C(s)+2Cl2 (g)=TiCl4(l)+2CO(g)△H=-81KJ•mol-1;
故答案为:TiO2(s)+2C(s)+2Cl2 (g)=TiCl4(l)+2CO(g)△H=-81KJ•mol-1;
(4)由工艺流程可知,生成中产生废气,废液,废渣等,不符合绿色化学理念,故答案为:产生了废气,废液,废渣等;
(5)8.34g FeS04•7H20样品物质的量=$\frac{8.34g}{278g/mol}$=0.03mol,其中m(H20)=0.03mol×7×18g/mol=3.78g,如晶体全部失去结晶水,固体的质量应为8.34g-3.78g=4.56g,可知在加热到373℃之前,晶体失去部分结晶水,
A.温度为78℃时,固体质量为6.72g,其中m(FeS04)=0.03mol×152g/mol=4.56g,m(H20)=6.72g-4.56g=2.16g,n(H20)=$\frac{2.16g}{18g/mol}$=0.12mol,则n(H20):n(FeS04)=0.12mol:0.03mol=4:1,则化学式为FeSO4•4H2O;温度为l59℃时,固体质量为5.10g,其中m(FeS04)=0.03mol×152g/mol=4.56g,m(H20)=5.10g-4.56g=0.54g,n(H20)=$\frac{0.54g}{18g/mol}$=0.03mol,则n(H20):n(FeS04)=0.03mol:0.03mol=1:1,则化学式为FeSO4•H2O;加热至373℃时,固体的质量为4.56g,其中m(FeS04)=0.03mol×152g/mol=4.56g;加热至633℃时,固体的质量为2.40g,其中n(Fe)=n( FeS04•7H20)=0.03mol,m(Fe)=0.03mol×56g/mol=1.68g,则固体中m(O)=2.40g-1.68g=0.72g,n(O)=$\frac{0.72g}{16g/mol}$=0.045mol,则n(Fe):n(O)=0.03mol:0.045mol=2:3,则固体物质Q的化学式为Fe2O3,FeSO4•7H2O晶体中有3种不同B结合力的水分子,故A错误;
B、由A知在100℃时,M的化学式为FeSO4•4H2O和FeSO4•H2O的混合物,故B错误;
C、由A知在200℃时,N的化学式为FeSO4•3H2O和FeS04的混合物,故C错误;
D、由A知铁的化合价升高,必有硫的化合价降低,即有二氧化硫生成,设SO2、SO3的物质的量分别为x、y,则$\left\{\begin{array}{l}{x+y=0.03}\\{64x+80y=4.56-2.40}\end{array}\right.$
解得$\left\{\begin{array}{l}{x=0.015}\\{y=0.015}\end{array}\right.$,所以方程式为:2FeSO4 $\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑,故D正确;
故选D;
(6)其电池反应为:3LiMn2O4+LiTi5O12$?_{放电}^{充电}$Li3Ti5O12+6MnO2,LiMn2O4中锰的化合价升高,发生氧化反应,所以阳极的电极反应式为:3LiMn2O4-3e-=3Li++6MnO2,放电时二氧化锰是正极发生还原反应,所以Li+从负极Li3Ti5O12移向下正极MnO2,故答案为:3LiMn2O4-3e-=3Li++6MnO2;Li+从负极Li3Ti5O12移向下正极MnO2.
点评 本题考查学生阅读题目获取信息能力、氧化还原反应、绿色化学、胶体、物质分离提纯,平衡常数计算,溶度积常数的计算应用,盖斯定律的计算应用等,难度不大,注意基础知识的掌握利用.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:选择题
| A. | 电池工作时,锌失去电子 | |
| B. | 电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e-═Mn2O3(s)+2OH-(aq) | |
| C. | 电池工作时,电子由正极通过外电路流向负极 | |
| D. | 外电路中每通过0.1 mol电子,锌的质量理论上减小3.25 g |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 离子半径:M->Z2->Y- | |
| B. | Z元素形成的氧化物都是共价化合物 | |
| C. | 气态氢化物稳定性:Y>Z>M | |
| D. | 三种元素中,M的最高价氧化物对应的水化物酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入过量Cl2,①、②均向右移动,溶液pH减小 | |
| B. | 加入CaCO3悬浊液,CaCO3的溶解平衡向右移动 | |
| C. | 加入澄清石灰水,c(H+)一定减小 | |
| D. | 加入一定量NaOH溶液后,溶液中离子浓度的关系可能为c(Cl-)+c(ClO-)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 把SO2通入紫色石蕊试液中 | 紫色褪去 | SO2具有漂白性 |
| B | 把浓硫酸滴到pH试纸上 | 试纸变红 | 浓硫酸具有酸性 |
| C | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2?N2O4 的△H>0 |
| D | 铝箔在酒精灯火焰上加热 | 铝箔熔化但不滴落 | 铝箔表面氧化铝熔点高于铝 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
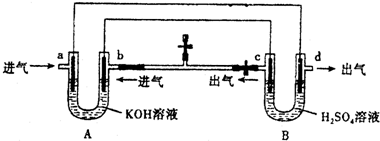
| A. | 装置A是原电池,装置B是电解池 | |
| B. | 反应一段时间后,装置B中溶液PH增大 | |
| C. | a口若消耗1molCH4,d口可产生4mol气体 | |
| D. | a口通入C2H6时的电极反应为 C2H6-14e-+18OH-═2CO32-+12H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向FeCl3溶液中滴加HI溶液:Fe3++2I-═Fe2++I2 | |
| B. | 向AlCl3溶液中加入过量的氨水:Al3++4NH3•H2O═Al${{O}_{2}}^{-}$+4N${{H}_{4}}^{+}$+2H2O | |
| C. | 向稀NH4HCO3溶液中加入过量NaOH溶液:N${{H}_{4}}^{+}$+OH-═NH3•H2O | |
| D. | 向苯酚钠溶液中通入少量CO2: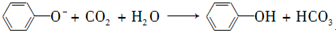 - - |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com