
| A. | CaO中有少量CaCO3(盐酸) | |
| B. | 氢气中含有少量氯化氢(苛性钠溶液) | |
| C. | 硫酸亚铁溶液中含有少量硫酸铜(铁粉) | |
| D. | CO2中有少量CO(灼热的氧化铜) |
分析 A.二者均与盐酸反应;
B.HCl与NaOH反应,而氢气不能;
C.Fe与硫酸铜反应生成硫酸亚铁和Cu;
D.CO还原CuO生成二氧化碳.
解答 解:A.二者均与盐酸反应,不能除杂,应利用加热法除杂,故A错误;
B.HCl与NaOH反应,而氢气不能,则利用NaOH溶液、洗气可除杂,故B正确;
C.Fe与硫酸铜反应生成硫酸亚铁和Cu,则加足量铁、过滤可除杂,故C正确;
D.CO还原CuO生成二氧化碳,则气体通过灼热的CuO可除杂,故D正确;
故选A.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的综合应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 金属钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 用醋酸除去水垢中的碳酸钙:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 硫酸氢钠溶液与氢氧化钡溶液恰好反应呈中性:2H++SO42-+Ba2++2OH-═2H2O+BaSO4↓ | |
| D. | 电解饱和MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一项 | B. | 二项 | C. | 三项 | D. | 四项 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3使湿润的红色石蕊试纸变蓝 | |
| B. | 向硅酸钠溶液中滴加适量稀盐酸,有透明的凝胶形成 | |
| C. | 将氯水长期放置,黄绿色消失 | |
| D. | 向Fe2(SO4)3溶液中滴加NaOH溶液,生成红褐色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.25 | B. | 0.1 | C. | 0.5 | D. | 0.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
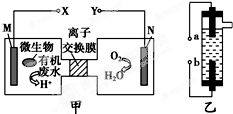
| A. | 装置甲可以在高温环境中工作 | |
| B. | 装置甲中N极发生的电极反应为O2+4H++4e-═2H2O | |
| C. | 装置乙中b极的电极反应式为2H++2e-═H2↑ | |
| D. | 装置乙的a极要与装置甲的Y极连接 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
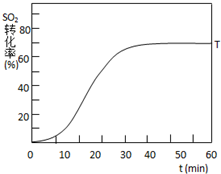 根据当地资源等情况,硫酸工业常用黄铁矿(主要成分为FeS2)作为原料.
根据当地资源等情况,硫酸工业常用黄铁矿(主要成分为FeS2)作为原料.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com