
����Ŀ�����г�����A-J���ʴ�������ת����ϵʾ��ͼ����Ӧ��������ȥ��,
��֪ͨ�������A��H Ϊ��̬�������ʣ�B��DΪ��̬�ǽ������ʣ�EΪ����ɫ���壬FΪ��ɫҺ�壬JΪ���ɫ��������ش��������⣺
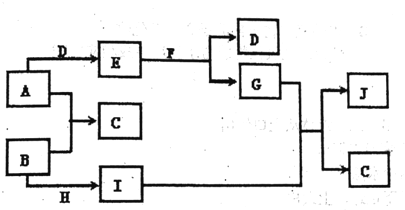
��1��д���������ʵĻ�ѧʽ��A_____��C____�� J ______��
��2��ת��I+G![]() J+C�ķ�Ӧ����Ϊ______��
J+C�ķ�Ӧ����Ϊ______��
��3��E���������Ӹ�������_______��ͬ������ĸ��
a.MgCl2 b.Na2O c.NaCl d.K2SO4
��4��д�����з�Ӧ�Ļ�ѧ����ʽ��
�� E+F![]() ________��
________��
�� B��G![]() _________��
_________��
��5��д��E��һ����;��_____________��
���𰸡� Na NaCl Fe(OH)3 ���ֽⷴӦ bd 2Na2O2+2H2O=4NaOH+O2�� Cl2+2NaOH=NaCl+NaClO+H2O ��������Ư��
����������֪ͨ�������A��HΪ��̬�������ʣ�B��DΪ��̬�ǽ������ʣ�EΪ����ɫ����Na2O2��FΪ��ɫҺ��ΪH2O��JΪ���ɫ����ΪFe��OH��3��GΪNaOH��DΪO2��AΪNa��BΪCl2��HΪFe��IΪFeCl3��CΪNaCl��
��1��������֪���ʵĻ�ѧʽAΪNa��CΪNaCl��JΪFe��OH��3��
��2��ת��I+G��J+C�ķ�Ӧ��FeCl3��GΪNaOH��Һ��Ӧ������������������FeCl3+3NaOH=Fe��OH��3��+3NaCl����Ӧ����Ϊ���ֽⷴӦ��
��3��EΪNa2O2������Na+��O22-���������Ӹ�����1:2��a��MgCl2�����к���Mg2+��Cl-���������Ӹ�����2:1����a����b��Na2O�����к���Na+��O2-���������Ӹ�����1:2����b��ȷ��c��NaCl�����к���Na+��Cl-���������Ӹ�����1:1����c����d��K2SO4�����к���K+��SO42-���������Ӹ�����1:2����d��ȷ����Ϊbd��
(4����E+F��D+G�ķ�ӦΪ�������ƺ�ˮ��Ӧ�����������ƺ���������Ӧ�Ļ�ѧ����ʽΪ��2Na2O2+2H2O=4NaOH+O2����
�� �����ܽ���NaOH��Һ����NaCl��NaClO����Ӧ�Ļ�ѧ����ʽΪCl2+2NaOH=NaCl+NaClO+H2O��
(5��Na2O2����CO2��Ӧ����̼���ƺ�������������������


 ����ȫ���ִʾ��ƪ��ϵ�д�
����ȫ���ִʾ��ƪ��ϵ�д� �����߿����ϵ�д�
�����߿����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������(C3H8)������ȼ�ϵ�غ�п���ؾ�Ϊ��;�㷺��ֱ����Դ���ŵ�ʱ���ߵ��ܷ�Ӧ�ֱ�ΪC3H8+5O2=3CO2+4H2O��2Zn+O2=2ZnO���ñ���(C3H8)ȼ�ϵ��Ϊп���س���װ����ͼ��ʾ������˵������ȷ����

A. ����MΪCO2
B. ȼ�ϵ������1mo1 O2ʱ����������4 mol OH-��bĤ��P�缫�ƶ�
C. aĤ��bĤ������ѡ�������ӽ���Ĥ
D. ��װ���У�п���صĸ�����ӦʽΪZn+2OH--2e-=ZnO+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��X��Y��Z��W��Ԫ�����ڱ��е����λ����ͼ��ʾ������Wԭ�ӵ����������������ڲ��������3���������ж���ȷ����
![]()
A��ԭ�Ӱ뾶��r(W)��r(Z)��r(Y)��r(X)
B��YԪ�صĵ���ֻ�ܸ��ᷴӦ�����ܸ��Ӧ
C�������̬�⻯������ȶ��ԣ�W��Z
D��WԪ�صĸ����������Ӧ��ˮ�����Ϊǿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���͵�أ���NaBH4(B�Ļ��ϼ�Ϊ+3��)��H2O2��ԭ�ϣ��õ�ؿ�������ˮ��̽������������Դ���乤��ԭ������ͼ��ʾ������˵������ȷ����

A. ÿ����3mol H2O2��ת��6mol e��
B. ��ع���ʱNa+��b��������a����
C. b���ϵĵ缫��ӦʽΪ��H2O2 + 2e��= 2OH��
D. a���ϵĵ缫��ӦʽΪ��BH4��+ 8OH����8e��=BO2��+6H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ�к��д���C1-��Na+������SO42-��Ca2+��Mg2+���õ��������Ըú�ˮ��Ʒ���е�����������ͼ��ʾ������˵���������
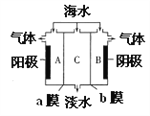
A. aĤ�������ӽ���Ĥ
B. A���Ҳ����������ʹʪ���KI������ֽ����
C. B���Ҳ������ݲ�����������������
D. ����������ɺ�A��B��C������pH��СΪpH(B)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����и���������ָ����Һ���ܴ����������
A. ��ʹpH��ֽ�����ɫ����Һ�У�Na+��NH4+��I����NO![]()
B. c(H+)/ c(OH�C) = 1��10 -12����Һ�У�K+��Na +��CO![]() �� SO42��
�� SO42��
C. pH=7����Һ�У�K+��NH4+��Fe3+��NO![]()
D. ������������H2����Һ��K����Mg2����SO![]() ��HCO
��HCO![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2.4g Mg��100mLϡ������ȫ��Ӧ����Ӧǰ����Һ����仯���Բ��ƣ�
��1�������������ڱ�״���µ������
��2����Ӧ��ȫ��������Һ��þ���ӵ����ʵ���Ũ�ȣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��F��ԭ��������������Ķ�����Ԫ�ء�A��B�ɷֱ���C��ɳ���������AC��AC2��BC��BC2�� 6��Ԫ����ԭ�Ӱ뾶������DԪ����E��F��Ԫ�ص��ʵķе���Ԫ��ԭ�������Ĺ�ϵ��ͼ(ͼ��ԭ����������)�������ж���˵����ȷ����
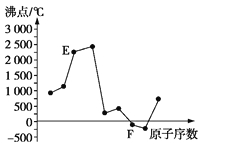
A��Ԫ��C��D��F��ԭ�Ӱ뾶��С�����˳��ΪF<C<D
B��Ԫ��B��E�γɵĻ�����������ƽ��ʯ�Ľṹ���۵����Ӳ�ȴ��������ڸû�������B��E֮����ڵ��ǹ��ۼ�
C��Ԫ��A��B��F������������Ӧ��ˮ���������ǿ������Ԫ��F�ĺ��������ǿ������
D��Ԫ��C��D��E����ɻ������ˮ��Һ�ʼ�����������Ԫ��E��F����ɻ������ˮ��Һ�����а�ɫ����������ͬʱ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��п��ϡ���ᷴӦ������˵��������ǣ� ��
A. ���ȿɼӿ췴Ӧ���� B. ����ϡ�����Ũ�ȿɼӿ췴Ӧ����
C. ����п���ɼӿ췴Ӧ���� D. ���п�Ĵ��ȿɼӿ췴Ӧ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com