
����Ŀ��������ij�������õ�����ࣨ��Ҫ����Fe2O3��CuO��Cr2O3�������������ʣ�����ͭ�������̣�
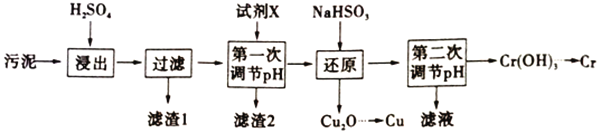
��ش��������⣺
��֪�������ʳ�����pH��CaSO4���ܽ���������£�
��1���ڽ��������г�����Cr2(SO4)3�⣬��Ҫ������__________________��
��2�������С���һ�ε��ڡ�pH����Ϊ�˳�ȥFe3+�������Լ�X������_______����дһ�֣���������Ũ��С�ڻ����1��10-5ʱ����Ϊ������ȫ����ҪʹFe3+��ȫ��������Ӧ������ҺpH��__________��֪��Ksp[Fe(OH)3]=8��10-38��1g2=0.3��
��3��д����ԭ����������Cu2O������Ӧ�����ӷ���ʽ______________________________���˲�������NaHSO3�����������˷��Լ��⣬�����ܳ��ֵ�������________________________��
��4�������С��ڶ��ε���pH��ӦС��9����ΪCr(OH)3���������������д��Cr(OH)3��NaOH��Һ��Ӧ�����ӷ���ʽ___________________________��
��5��Cr(OH)3���ȷֽ�ΪCr2O3���������ȷ����Եõ�����Cr��д�����������ȷ�ұ���õ�����Cr�Ļ�ѧ����ʽ________________________________��
��6����ѧ������(COD)������ˮ�����л�����Ⱦ�ij̶ȣ���K2Cr2O7��ǿ����������ˮ��ʱ�����ĵ�K2Cr2O7����������൱��O2�ĺ�������mg��L-1�ƣ���������
�ٴ���ʱ��ˮ��Ӧ���ữ�����ѡ��__________��ѡ�ϡ���ᡱ����ϡ���ᡱ��ϡ���ᡱ���ữ��
���ڸ������£�Cr2O72-����ת��ΪCr3+��ȡˮ��100mL��������ˮ��ʱ������10mL0.025 mol��L-1 K2Cr2O7��Һ�����ˮ����CODΪ__________ mg��L-1��
���𰸡� Fe2(SO4)3��CuSO4 CuO��Cu(OH)2��CuCO3��Cr2O3�ȣ�������������ɣ� 3.3 2Cu2+ +HSO3- +2H2O== Cu2O��+ SO42-+ 5H+ ����SO2����Ⱦ��������Cu2O��H+��Ӧ����������������ɵã� Cr(OH)3 + OH��== CrO2��+ 2H2O [��Cr(OH)3 + OH��= Cr(OH)4��] Cr2O3+2Al![]() Al2O3+2Cr ϡ���� 120
Al2O3+2Cr ϡ���� 120
�������������������1���ڽ���������Fe2O3��CuO��Cr2O3�����ᷴӦ����Fe2(SO4)3��CuSO4��Cr2(SO4)3����2����������ͼ����һ�ε��ڡ�pH������Һ�к���Cu2+��Cr3+����ȥFe3+��������������������Ksp[Fe(OH)3]�ɼ���Fe3+����Ũ��С�ڻ����1��10-5ʱOH����Ũ������3����ԭ������Cu2+��HSO3-��ԭΪCu2O��NaHSO3���ᷴӦ����SO2����4��Cr(OH)3����������������Cr(OH)3���������Ʒ�Ӧ����NaCrO2����5��Cr2O3������Ӧ������������Cr����6������������������,K2Cr2O7�����������������ݵ����غ� ��1mol K2Cr2O7�൱��1.5molO2��
��������1���ڽ���������Fe2O3��CuO��Cr2O3�����ᷴӦ����Fe2(SO4)3��CuSO4��Cr2(SO4)3�����Գ�����Cr2(SO4)3�⣬��Ҫ������Fe2(SO4)3��CuSO4����2����������ͼ����һ�ε��ڡ�pH������Һ�к���Cu2+��Cr3+����ȥFe3+�������������������Լ�����Լ�������CuO��Cu(OH)2��CuCO3��Cr2O3����Fe3+����Ũ��С�ڻ����1��10-5ʱOH����Ũ����![]() ��c(H+)=
��c(H+)=![]() ������PH=3.3����3����ԭ������Cu2+��HSO3-��ԭΪCu2O�����ӷ���ʽ��2Cu2+ +HSO3- +2H2O== Cu2O��+ SO42-+ 5H+����NaHSO3������NaHSO3���ᷴӦ����SO2����Ⱦ��������4��Cr(OH)3����������������Cr(OH)3���������Ʒ�Ӧ����NaCrO2����Ӧ���ӷ���ʽ��Cr(OH)3 + OH��== CrO2��+ 2H2O����5��Cr2O3������Ӧ������������Cr����Ӧ����ʽ��Cr2O3+2Al
������PH=3.3����3����ԭ������Cu2+��HSO3-��ԭΪCu2O�����ӷ���ʽ��2Cu2+ +HSO3- +2H2O== Cu2O��+ SO42-+ 5H+����NaHSO3������NaHSO3���ᷴӦ����SO2����Ⱦ��������4��Cr(OH)3����������������Cr(OH)3���������Ʒ�Ӧ����NaCrO2����Ӧ���ӷ���ʽ��Cr(OH)3 + OH��== CrO2��+ 2H2O����5��Cr2O3������Ӧ������������Cr����Ӧ����ʽ��Cr2O3+2Al![]() Al2O3+2Cr����6������������������,K2Cr2O7���������ᣬ�������ѡ��ϡ�����ữˮ���������ݵ����غ� ��1mol K2Cr2O7�൱��1.5molO2��10mL0.025 mol��L-1 K2Cr2O7��Һ�൱��
Al2O3+2Cr����6������������������,K2Cr2O7���������ᣬ�������ѡ��ϡ�����ữˮ���������ݵ����غ� ��1mol K2Cr2O7�൱��1.5molO2��10mL0.025 mol��L-1 K2Cr2O7��Һ�൱��![]() O2����ˮ����CODΪ
O2����ˮ����CODΪ![]() mg��L-1��
mg��L-1��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֣���Ա��е�a~gԪ��,�ش��������⣺
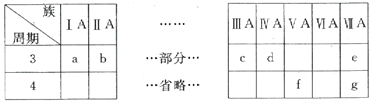
(1)dԪ��λ�ڽ�����ǽ����ķֽ��ߴ�,������__________���ϡ�
(2)f��Ԫ�ط���ΪAs,�����������Ļ�ѧʽΪ__________��
(3)a��b��c����Ԫ�ص�����������Ӧˮ����ļ�������,�Դ�ԭ�ӽṹ�ĽǶȽ��������仯����__________��
(4)eԪ�صķǽ�����ǿ��g,��д��һ�����ӷ���ʽ֤����__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�������ȡһ���������ѷ����ǣ� ��
A. ���������ȡ����Ӧ B. ��ϩ�������ӳɷ�Ӧ
C. ��ϩ��HCl�ӳɷ�Ӧ D. ��Ȳ��HCl�ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з����У����ڷǼ��Է��ӵ���( )
A. SO2 B. BeCl2 C. CH3Cl D. COCl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��X��Y��Z��W��Q��Ԫ�����ڱ��е����λ����ͼ��ʾ������˵����ȷ����( )
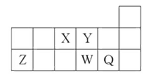
A. Ԫ��X��Ԫ��Z����������ϼ�֮�͵���ֵ����8
B. ԭ�Ӱ뾶�Ĵ�С˳��Ϊ��r(X)>r(Y)>r(Z)>r(W)>r(Q)
C. ����Y2-��Z3+�ĺ���������͵��Ӳ���������ͬ
D. Ԫ��W������������Ӧ��ˮ��������Ա�Q��ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״�����Ҫ�Ĺ�ҵԭ�ϣ�ú������������ú̿��ȡˮú���Ӷ��ϳɼ״���CO��g��+2H2��g��CH3OH��g������֪���³�ѹ�·�Ӧ�������仯��ͼ1��ʾ�� 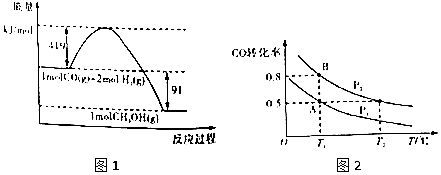
��
��ѧ�� | H��H | H��O | O=O |
����kj/mol | 436 | x | 496 |
��CO��g��+ ![]() O2��g��=CO2��g����H=��280kJ/mol
O2��g��=CO2��g����H=��280kJ/mol
H2��g��+ ![]() O2��g��=H2O��I����H=��284kJ/mol
O2��g��=H2O��I����H=��284kJ/mol
H2O��I��=H2O��g����H=+44kJ/mol
��ش��������⣺
��1���״�����ֽ�ΪCO��H2����������һ��Ӧ�Ļ��Ϊkj/mol��
��2����д����ʾ��̬�״�ȼ���ȵ��Ȼ�ѧ����ʽ��
��3��H��O�ļ���xֵΪ��
��4����ͼ2����һ�ݻ��ɱ���ܱ������г���10molCO�����30molH2���壬���ﵽƽ��״̬Aʱ�����������Ϊ20L���練Ӧ��ʼʱ�Գ���10molCO��30molH2 �� ����ƽ��״̬Bʱ���������V��B��=L��
��5���ڼס��ҡ���������ͬ�ܱ������а���ͬ��ʽͶ�ϣ�һ�������·����÷�Ӧ����ʼ�¶Ⱥ���ʼ�����ͬ����Ӧ��������ﷴӦǰ���Ϊ��̬����������������ʾ��
���� | �� | �� | �� |
������� | ���º��� | ���Ⱥ��� | ���º�ѹ |
��Ӧ��Ͷ�� | 1molCO��2molH2 | 1molCH3OH | 1molCH3OH |
ƽ��ʱ������� | V���ף� | V���ң� | V������ |
��Ӧ��ƽ�ⳣ��K | K���ף� | K���ң� | K������ |
ƽ��ʱCH3OH��Ũ��/molL��1 | C���ף� | C���ң� | C������ |
ƽ��ʱCH3OH�ķ�Ӧ����/molL��1min��1 | v���ף� | v���ң� | v������ |
������˵����ȷ������ �� ��
A.V���ף���V������
B.K���ң���K������
C.c���ң���c���ף�
D.v���ף�=v������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ�����ж�1mol�����������������
A.����Ϊ4gB.��״�������ԼΪ22.4L
C.����2NA����ԭ��D.����NA����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ4NH3��g��+5O2�T4NO��g��+6H2O��g����10L�ܱ������н��У�����Ӻ�ˮ���������ʵ���������0.45mol����˶�ʱ���ڣ��÷�Ӧ������v�ɱ�ʾΪ��������
A.v��NH3��=0.010mol/��L��s��
B.v��O2��=0.010mol/��L��s��
C.v��NO��=0.0010mol/��L��s��
D.v��H2O��=0.045mol/��L��s��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��λ��3����ͬ�����ڵ�����Ԫ��a��b��c��d��e��ԭ������������������b��dͬ���壬dԪ������ϼ�����ͻ��ϼ۴����͵���4��cԭ��������������bԭ�Ӵ�����������1���ش��������⡣
(1)д��a��Ԫ�ط���_____��b�����ڱ��е�λ���ǵ�___����____�壻
(2)a��e�γɵ���_____(����ӡ����ۡ�)�����
(3)��������Ԫ���У��ǽ�������ǿ����______(��Ԫ������)��
(4)dԪ������������Ӧˮ����Ļ�ѧʽ��______��d��e����̬�⻯���ȶ���ǿ����_________(�ѧʽ)��
(5)Ԫ��c��ԭ�ӽṹʾ��ͼΪ____��c�ĵ�����a��ͬ�����3����Ԫ������������Ӧˮ���ﷴӦ�����ӷ���ʽΪ____________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com