
把一块镁铝合金投入到1 mol/L酸中,待合金完全溶解后,再往溶液里加入1 mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液的体积变化的关系如下图所示,下列说法中错误的是( )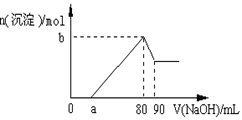
| A.盐酸的体积为80ml | B.a的取值范围为0≤ a <50 |
| C.n(Mg2+)<0.025mol | D.当a值为30时,b值为0.01 |
D
解析试题分析:A.当沉淀达到最大值时,溶液为NaCl溶液,n(HCl)=n(NaOH)= 1 mol/L×0.08L=0.08mol;由于盐酸的浓度是1 mol/L,所以盐酸的体积是0.08L=80ml,正确;B. Al3++3OH-=Al(OH)3↓;Al(OH)3+ OH-= AlO2-+ 2H2O.由于溶解Al(OH)3消耗NaOH10mol,则形成Al(OH)3消耗NaOH30mol;而且其中含有沉淀Mg2+消耗的NaOH溶液,因此a的取值范围为0≤ a <50,正确;C.根据图像可知n(Al3+)=" 1" mol/L×0.01L="0.01mol" ,则溶液中Al3+形成Al(OH)3消耗NaOH0.03mol,H+、Mg2+共消耗NaOH的体积是50ml,因此n(Mg2+)<0.05mol÷2=0.025mol,正确;D.当a值为30时,n(Mg(OH)2)=0.01mol,n(Al(OH)3)=0.01mol;所以b值为0.02,错误。
考点:考查图像法在有关金属镁铝及其化合物的计算中的应用的知识。


科目:高中化学 来源: 题型:实验题
(10分)某研究性学习小组同学向Fe(NO3)3溶液中滴加淀粉KI溶液后,溶液呈蓝色。他们对Fe(NO3)3溶液中将I-氧化的氧化剂进行了如下探究:
【实验】分别向FeCl3溶液和HNO3溶液中滴加淀粉KI溶液后,发现溶液均显蓝色。
(1)FeCl3溶液与KI溶液反应的离子方程式为 。
(2)KI与HNO3反应的离子方程式为I-+H++NO3-→NO↑+I2+H2O(未配平),反应中氧化剂与还原剂的物质的量之比为 。
【提出假设】假设1:氧化剂只有Fe3+ 假设2:氧化剂只有NO3-(H+)
【设计实验方案,验证假设】
(3)请设计实验验证上述假设
供选试剂:0.2mol?L-1的Fe(NO3)3溶液、0.2mol?L-1的KI溶液、0.01mol?L-1的KMnO4酸性溶液、0.01mol?L-1的KSCN溶液、CCl4溶液、淀粉溶液。(提示:NO3-在不同条件下的还原产物较复杂,有时难以观察到气体产生)
| 实验步骤 | 预期现象和结论 |
| ①取5ml0.2mol?L-1的Fe(NO3)3溶液和5ml0.2mol?L-1的KI溶液,充分反应后加入5ml CCl4溶液,振荡静置,取上层溶液,分置于A、B两支试管中 | |
| ② ③ | 若溶液不变红色,则假设1成立,否则假设1不成立; 若溶液显紫色,则假设2成立,否则假设2不成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学小组在学习元素周期律后,对教材中Fe2+氧化为Fe3+的实验进一步思考,并提出问题:Cl2能将Fe2+氧化为Fe3+,那么Br2和I2能否将Fe2+氧化为Fe3+?
环节一:理论推测
部分同学认为Br2和I2都可能将Fe2+氧化为Fe3+,他们思考的依据是 。
部分同学认为Br2和I2都不能将Fe2+氧化为Fe3+,还有同学认为Br2能将Fe2+氧化为Fe3+而I2不能。他们思考的依据是从上到下卤素单质氧化性减弱。
环节二:设计实验进行验证
在大试管中加适量铁粉,加入10 mL 稀盐酸,振荡试管,充分反应后,铁粉有剩余,取上层清液进行下列实验。
实验1:
| 试管 | 操作 | 现象 |
| ① | 先向试管中加入2 mL FeCl2溶液,再滴加少量红棕色的溴水,振荡试管 | 溶液为黄色 |
| ② | 先向试管中加入2 mL FeCl2溶液,再滴加少量棕黄色的碘水,振荡试管 | 溶液为黄色 |
| 操作 | 应该观察到的现象 |
| | |
| 操作 | 现象 |
| 向试管②所得溶液中继续加入0.5 mLCCl4,充分振荡,静置一段时间后。取出上层溶液,滴加KSCN 溶液 | 静置后,上层溶液几乎无色,下层溶液为紫色;上层溶液滴加KSCN 溶液后,出现浅红色 |
| 操作 | 现象 |
| 向另一支试管中加入2 mL FeCl2溶液,滴加0.5mL碘水后,再加入0.5mL 乙酸乙酯,充分振荡,静置一段时间后。取出下层溶液,滴加KSCN 溶液 | 静置后,上层液为紫色,下层液几乎无色;下层溶液滴加KSCN溶液后,没有出现浅红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
有A、B两个完全相同的装置,某学生分别在它们的侧管中装入1.06 g Na2CO3和0.84 g NaHCO3,A、B中分别有10 mL相同浓度的盐酸,将两个侧管中的物质同时倒入各自的试管中,下列叙述正确的是
A.A装置的气球膨胀速率大
B.若最终两气球体积相同,则盐酸的浓度一定大于或等于2 mol/L
C.若最终两气球体积不同,则盐酸的浓度一定小于或等于1 mol/L
D.最终两试管中Na+、Cl-的物质的量一定相同
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
纯碱和小苏打都是白色晶体,在日常生活中都可以找到。若要在家中将它们区分开来,下面的方法中可行的是
| A.分别放在炒锅中加热,观察是否有残留物 |
| B.分别用干净铁丝蘸取样品在煤气炉的火焰上灼烧,观察火焰颜色 |
| C.将样品溶解,分别加入澄清石灰水,观察是否有白色沉淀 |
| D.在水杯中各盛相同质量的样品,分别加入等体积的白醋,观察反应的剧烈程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下图是侯氏制碱法在实验室进行模拟实验的生产流程示意图,则下列叙述正确的是( )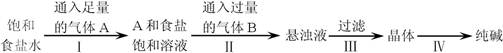
| A.A气体是CO2,B气体是NH3 |
| B.第Ⅲ步得到的晶体是Na2CO3·10H2O |
| C.第Ⅱ步的离子方程式为Na++NH3·H2O+CO2===NaHCO3↓+NH |
| D.第Ⅳ步操作的主要过程有溶解、蒸发、结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
类推的思维方法是化学学习和研究中常用的重要思维方法,但所得结论要经过实践的检验才能确定其正确与否。根据你所掌握的知识,判断下列类推结论中正确的是
| | 化学事实 | 类推结论 |
| A | pH=3的盐酸稀释1000倍后pH=6 | pH=6的盐酸稀释1000倍后pH=9 |
| B | 用电解熔融MgCl2的方法冶炼金属镁 | 用电解熔融NaCl的方法冶炼金属钠 |
| C | 将SO2通入BaCl2溶液中无沉淀生成 | 将SO2通入Ba(NO3)2溶液中也无沉淀生成 |
| D | Al在O2中燃烧生成Al2O3 | Fe在O2中燃烧生成Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关物质性质、应用的说法正确的是
| A.小苏打可与酸反应,可用作治疗胃酸过多的药剂 |
| B.氯化铝是电解质,可电解其水溶液获得金属铝 |
| C.SO2具有漂白性,可用于将银耳漂白为“雪耳” |
| D.二氧化硅具有导电性,可用于生产光导纤维 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com