
【题目】由硫铁矿“烧渣”(主要成分:Fe3O4、Fe2O3和FeO)制备绿矾(FeSO4·7H2O))的流程如图:

已知:FeS2(S的化合价为-1)难溶于水。
(1)①中加入的酸为___,滤渣2的主要成分是___。
(2)①中生成Fe3+的离子方程式为Fe3O4+8H+=2Fe3++Fe2++4H2O、___。
(3)检验②中Fe3+已经完全转化成Fe2+的实验方法:取适量溶液2,___。
(4)通过③得到绿矾晶体的实验操作:加热浓缩、冷却结晶、___。
【答案】硫酸(H2SO4) FeS2 Fe2O3+6H+=2Fe3++3H2O 向其中滴加KSCN溶液,溶液不变红 过滤、洗涤、干燥
【解析】
烧渣(主要成分:Fe3O4、Fe2O3和FeO)均溶于硫酸,溶液1含Fe2+、Fe3+,步骤②发生FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,步骤③为蒸发浓缩、冷却结晶析出绿矾,以此解答该题。
(1)因绿矾的酸根离子为硫酸根离子,则步骤①,应用硫酸来溶解烧渣;步骤②发生FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,因为FeS2难溶于水,所以滤渣2的主要成分是FeS2,故答案为:硫酸(H2SO4);FeS2;
(2)①中生成Fe3+的物质有Fe3O4、Fe2O3,则另一个离子反应为Fe2O3+6H+=2Fe3++3H2O,故答案为:Fe2O3+6H+=2Fe3++3H2O;
(3)可向其中加入KSCN溶液,溶液不变红,则可说明②中Fe3+已经完全转化为Fe2+,故答案为:向其中滴加KSCN溶液,溶液不变红;
(4)通过③得到绿矾晶体的实验操作:加热浓缩、冷却结晶、过滤、洗涤、干燥,故答案为:过滤、洗涤、干燥。


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明溶液中:K+、MnO4-、Cl-、H+
B.![]() 的溶液中:Ba2+、K+、NO3-、ClO-
的溶液中:Ba2+、K+、NO3-、ClO-
C.含Na2SO3的溶液中:K+、H+、Cl-、NO3-
D.pH=12的无色溶液:K+、Na+、CH3COO-、Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E四种短周期元素的原子序数逐渐增大。A为非金属元素,且A、E同主族,C、D为同周期的相邻元素。E原子的质子数等于C、D原子最外层电子数之和。B原子最外层电子数是内层电子数的2倍。C的氢化物分子中有3个共价键,试推断:
(1)写出B元素在周期表中的位置____________________;
(2)由A、C、D所形成的离子化合物是_______________(填化学式),所含化学键类型为_____________,它与E的最高价氧化物对应水化物的溶液加热时反应的离子方程式是___________________________。
(3) C单质的电子式为____________________。
(4) B和D相比,非金属性较强的是_________________(用元素符号表示),下列事实能证明这一结论的是________________(选填字母序号)。
a.常温下,B的单质呈固态,D的单质呈气态 b.D的氢化物的稳定性强于B的氢化物
c.B与D形成的化合物中,B呈正价 d.D的氢化物的沸点高于B的氢化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在![]() 的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )
的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )
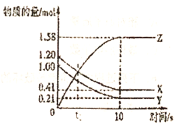
A.![]() 后,该反应停止进行
后,该反应停止进行
B.反应的化学方程式为:![]()
C.在t1时刻,正反应速率等于逆反应速率
D.反应前![]() 内,以Z表示的平均反应速率为
内,以Z表示的平均反应速率为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | 85.5 | 115.2 | >600(分解) | 75.5 | 16.8 | 10.3 |
沸点/℃ | 60.3 | 444.6 | 10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为__________,基态S原子电子占据最高能级的电子云轮廓图为_________形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是_________。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为__________。

(4)气态三氧化硫以单分子形式存在,其分子的立体构型为_____形,其中共价键的类型有______种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为___________g·cm3;晶胞中Fe2+位于![]() 所形成的正八面体的体心,该正八面体的边长为______nm。
所形成的正八面体的体心,该正八面体的边长为______nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D都是周期表中的短周期元素,它们的核电荷数依次增大。A原子、C原子的L能层中都有两个未成对的电子,C、D同主族。E、F都是第四周期元素,E原子核外有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满。根据以上信息填空:
(1)基态D原子中,电子占据的最高能层符号为____,D基态原子含有_____个未成对电子。
(2)E2+的价层电子排布图是_______,F原子的电子排布式是_____。
(3)A的最高价氧化物对应的水化物分子结构式为____,其中心原子采取的轨道杂化方式为____,B的气态氢化物的VSEPR模型为_____。
(4)化合物AC2、B2C和阴离子DAB-互为等电子体,它们结构相似,DAB-的结构式为____。
(5)配合物甲的焰色反应呈紫色,其内界由中心离子E3+与配位体AB-构成,配位数为6。甲的水溶液可以用于实验室中E2+的定性检验,检验E2+的离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.4.6gC2H5OH与6.0gCH3COOH反应,生成的CH3COOC2H3分子数目为0.1NA
B.22gCO2与标准状况下11.2LHF含有相同分子数
C.25℃时,1LpH=12的Ba(OH)2溶液中含有的OH-数目为0.02NA
D.32gO2和O3的混合物中含有的氧原子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员研制出一种室温“可呼吸”Na—CO2电池。放电时该电池“吸入”CO2,充电时“呼出”CO2。吸入CO2时,其工作原理如图所示。吸收的全部CO2中,有2/3转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面。下列说法正确的是

A.“吸入”CO2时,钠箔为负极
B.“吸入”CO2时的正极反应:4Na++3CO2-4e-=2Na2CO3+C
C.“呼出”CO2时,Na+向多壁碳纳米管电极移动
D.每“呼出”22.4LCO2,转移电子数为0.75mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述正确的是
A.再通入少量氯气,c(H+)/c(ClO-)减小
B.通入少量SO2,溶液漂白性增强
C.加入少量固体NaOH,一定有c(Na+)=c(Cl-)+c(ClO-)
D.加入少量水,水的电离平衡向正反应方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com